
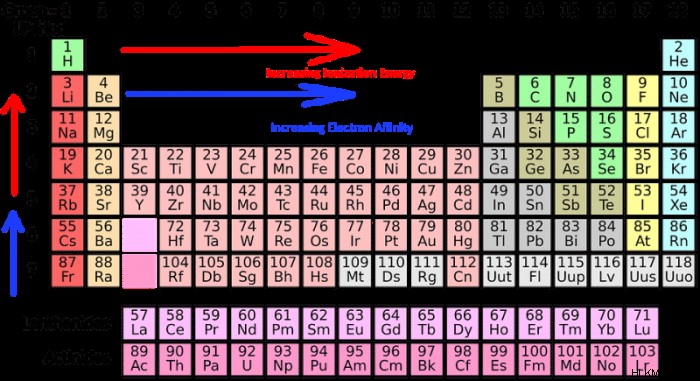
元素の周期表は、発見されたすべての化学元素を表したものです。周期表の元素は、上から下、左から右に原子番号の昇順で並んでおり、一般に、元素の順序は原子質量と相関しています。この記事では、元素のラベル付きの周期表と、周期表に関連する傾向に関する情報、または表をよりよく理解するために使用できるパターンについて説明します。
周期表の解釈
周期表の行は周期と呼ばれ、周期表の列はグループと呼ばれます。元素の周期数は、その元素の電子が持つ最高のエネルギー準位を表します。同じ列内にある元素は、同じ電子分布を持っているため、化学的性質と反応が非常に似ています。
周期表の傾向
イオン半径の傾向
イオン半径の傾向は、周期表を上から下にたどると、表内の元素のイオン半径が増加する傾向があることを示しています。イオン半径は、表を左から右に読むにつれて減少する傾向があります。

イオン半径とは正確には何ですか?簡単な定義として、原子のイオン半径は、原子が結晶格子の内側に配置されている場合のイオンの測定値です。より具体的には、原子のイオン半径は、互いにかろうじて接触しているイオン間の距離の半分として定義されます。 2 つの異なる原子の正確な電子殻境界を正確に測定することは非常に難しいため、原子のイオンは通常、あたかも固体であるかのように記述されます。イオン半径は原子半径とは異なり、原子半径は中性原子が持つ半径であり、イオン半径はこれより少し大きくても小さくてもかまいません。
イオン半径のサイズは、イオンが持つ粒子電荷のタイプに影響します。正に帯電したイオン、または陽イオンは、通常、元素の中性原子よりも小さいです。これは、電子が原子の殻から取り除かれ、その結果、電子を取り囲む電子が原子核により大きな引力を経験するためです。一方、より大きなイオン半径は通常、陰イオンとも呼ばれる負に帯電したイオンを示します。
イオン化エネルギーの傾向
イオン化エネルギー トレンドは通常、周期表全体で顕著なパターンまたはトレンドに従います。イオン化エネルギーは、周期表の上から下に移動すると減少し、左から右に移動すると増加する傾向があります.
イオン化エネルギーという用語は、電子を放出させるためにイオンによって吸収されなければならないエネルギーの総量または量を指します。最初は中性である原子の場合、通常、最初の電子を放電するために必要なエネルギーは、2 番目の電子を放電するよりも少なく、3 番目の電子を放電するには、2 番目の電子を放電するよりも多くのエネルギーが必要です。 .
イオンから後続のすべての電子を除去するために、より多くのエネルギーが必要な理由は、電子が除去されると、イオンがより正になるためです。イオンの陽性度が高いほど、より多くの電子がイオンに引き付けられるため、イオンから電子を分離することはますます困難になります。電子と原子核の間の距離が大きいほど、電子が原子から簡単に取り除かれます。そのため、イオン化エネルギーは原子半径に関連していると考えられています。
電子親和力の傾向
電子親和力とは、電子が中性原子に追加されたときにどれだけのエネルギーが消費または放出されるかを指します。別の言い方をすれば、中性原子に電子が追加されるたびにどれだけのエネルギーが変化するかを指します.
電子親和力トレンドとは、周期表が左から右に移動するにつれて電子親和力が増加する傾向があることを指します。電子親和力の傾向の補完的な部分は、周期表が上から下に移動するにつれて電子親和力が一般に減少することです。原子のイオンは、正味の負電荷または正味の正電荷を持つことができます。前述のように、正味の負電荷を持つイオンは陰イオンと呼ばれ、正電荷を帯びた原子は陽イオンと呼ばれます。
電子親和力とイオン化エネルギーの違いは次のとおりです。イオン化エネルギーは正イオンの形成をカバーし、電子親和力は負イオンをカバーします。電子親和力の使用は、ほとんどの場合、16 族と 17 族にある元素に限定されます。
原子の電子親和力は、電子がいつ原子に付加されるかによって異なります。最初の電子が中性原子に追加されると、それは常に負のエネルギーを持ち、これが最初の電子親和力です。これは、神経原子に電子が追加されるとエネルギーが放出され、イオンが負になるためです。追加のマイナスイオンを追加するには、ますます多くのエネルギーが必要です。イオンを追加するために必要なエネルギーは、電子付着プロセスによって放出されるエネルギーを上回るため、2 番目の電子親和力は正になります。
電気陰性度の傾向
電気陰性度トレンドとは、周期表を左から右、または上から下にたどると、電気陰性度レベルがどのように変化するかを指します。一般に、電気陰性度のレベルは、周期表を上から下にたどると増加する傾向があり、周期表を左から右に移動すると増加します。
電気陰性度とは、原子が化学結合で見られる電子に対してどの程度の影響または「魅力」を持っているかを指します。別の言い方をすれば、原子が特定の化合物の一部である場合に電子を引き付ける原子の能力を表します。極性共有結合は、化学結合を構成する電子が、別の原子よりも 1 つの原子に対して弱い引力を持つ場合に作成されます。対照的に、共有結合は、2 つの原子が同じ電気陰性度の値を持つ場合に作成され、電子を正確に共有します。
2 つの原子間の電気陰性度の差が非常に大きい場合、2 つの原子はそれらの間で電子をまったく共有しません。電気陰性度の大きい原子は、基本的に他の原子から電子を奪い、その結果、イオン結合が形成されます。異なる原子です。原子の電気陰性度の値は 0.7 から 3.98 で、水素の値は 2.20 で、スケールの基礎として使用されます。
原子半径の傾向
「原子半径」という用語は、原子のサイズを表します。原子半径を正確に測定するのは難しい場合があります。これは、主に原子半径を定義する方法が競合していることが原因です。原子半径を測定するさまざまな方法には、ファン デル ワールス半径、共有結合半径、金属半径、およびイオン半径が含まれます。
ファン デル ワールス半径は、結合していない 2 つの原子が最も接近する間に存在する、定義された要素内の距離を表します。金属半径は、2 つの金属イオンが金属格子内にある場合に取得され、これら 2 つの金属イオン間の距離の半分です。共有結合半径は、特定の共有結合の一部を構成する原子のサイズを表します。最後に、イオン半径は、結晶格子がイオンを保持している場合に取得され、2 つの異なるイオンの 2 つの原子核間の距離の半分であり、かろうじて接触しています。
原子半径トレンドとは、周期表に従って元素のグループをたどると、原子半径が増加する傾向があるという事実を指します。これは、列を下に移動すると、新しい行ごとに別の電子殻が原子に追加されるという事実を反映しています。周期表で。原子番号が上がるにつれて原子あたりの電子数が増えるため、周期表を左から右に移動するにつれて原子半径が小さくなる傾向があります。
金属、半金属、非金属
周期表の元素をグループ化する方法の 1 つは、金属、メタロイド/半金属、および非金属の 3 つの異なるグループのいずれかに分類するさまざまな特性によるものです。
周期表にある元素のほとんどは金属であり、金属は次のような特性によって区別されます:
- ツヤがあること、ツヤが高いこと
- 通常、室温で固体
- 電気と熱の良導体
- 順応性
- 高密度
- 簡単に電子を放出
半金属または半金属は、金属と非金属の中間にある特性を持っています。これらのプロパティは次のとおりです:
- くすんでいるか光沢がある
- しばしば効果的な半導体
- 化学反応で電子を失ったり獲得したりできる
- いくつかの異なるフォームがあります
非金属は、金属とはまったく異なる特性を持つ元素です。酸素のような希ガスは非金属です。非金属には次のような特徴があります:
- もろいことが多い
- 金属に比べて融点が低い
- 電気や熱をうまく伝えない
- 金属に比べてはるかに密度が低い
- 化学反応に関与すると、しばしば電子を獲得します
- くすんでいて、光沢がない







