物質と分子間の力の状態:
* ガス: ガス中の分子は遠く離れており、自由に動きます。弱い分子間力(ヴァンデルワールスの力など)はそれらをまとめることができません。
* 液体: 液体内の分子は互いに近く、分子間力が強くなります。彼らはお互いを通り過ぎて動くことができ、液体に流動性を与えます。
* ソリッド: 固体の分子はしっかりと詰め込まれており、最も強い分子間力を持っています。これらの力は、分子を剛性構造に保持します。
分子間力が増加する理由:
* 距離: ガスから固体に移動すると、分子は一緒に近づきます。これにより、それらの間の距離が減り、引力が強くなります。
* 運動エネルギー: ガス内の分子は、固体の分子よりもはるかに高い運動エネルギー(運動エネルギー)を持っています。 このエネルギーは、分子を分離したままにして、引力に対抗します。固体では、運動エネルギーははるかに低く、分子間力が支配的になります。
分子間力のタイプ:
* van der Waals Force: これらは、分子周辺の電子分布の一時的な変動から生じる弱い一時的な力です。
* 双極子型力: これらは、永久的な正と負の端を持つ極地分子間で発生します。
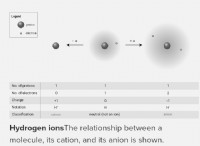
* 水素結合: これは、水素原子が酸素や窒素のような高電気陰性原子に結合したときに発生する特別なタイプの双極子双極子力です。水素結合は非常に強く、多くの生物学的プロセスで重要な役割を果たしています。
要約:
ガスから固体に移動すると、分子は近づき、分子間力が強くなります。これらの力は分子の運動エネルギーを克服し、固定された剛性構造をもたらします。