* 物質と分子間の力の状態: 2つの分子間の力の違いは、物質の異なる状態、固体と液体、および分子間力の性質から生じます。
* 固体状態: 固体では、分子は密接に詰め込まれ、強い分子間力によって一緒に保持されます。これらの力は次のとおりです。
* イオン結合: 反対に帯電したイオン間の強い静電力。
* 共有結合: 原子間の電子の強力な共有。
* 水素結合: 水素を含む強力な双極子双極子相互作用。
* van der Waals Force: 電子分布の一時的な変動による弱い魅力。
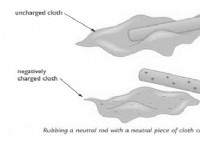
* 液体状態: 液体では、分子はよりゆるく詰め込まれており、分子間力が弱くなっています。固体状態に存在する力の一部は持続する可能性がありますが、分子間の距離と移動の自由の増加により、それらはあまり効果的ではありません。
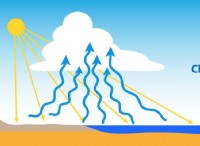
* 融解: 固体が溶けると、熱エネルギーの増加は、分子を固定格子に保持する強力な分子間力を克服します。これにより、分子は剛性構造から解放され、より自由に移動するようになり、相互作用が弱い状態が低下します。
したがって、2つの分子間の力は、固体状態と比較して液体状態で弱くなります。 分子間力のこの違いは、固体(固定された形状、剛性)と液体(流体、容器の形状を取る)の異なる特性を定義するものです。