VSEPR 理論とは
VSEPR 理論は、原子価殻電子対反発理論の略で、幾何学的構造に基づいて分子を編成する方法です。化学では、VSEPR 理論は、分子内の各原子が価電子対間の距離を最大化するジオメトリを探し、電子間の反発を最小化するという原則に基づいています。価電子は負に帯電しており、同様の電荷が反発するため、互いに反発します。
中心原子に孤立電子対を持たない分子の VSEPR 理論
わかりやすく整理するために、VSEPR 構造を 2 つのカテゴリに分けます。中心原子に孤立電子対があるものと、中心原子に孤立電子対がないものです。
線形
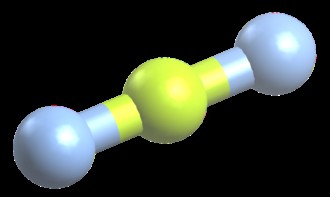
BeF2 線状分子の例です。 BeF2 には合計 16 個の価電子があります。 各フッ素原子に 3 つの孤立電子対 (6 つの電子) を持つ分子。それぞれのフッ素原子上のこれらの非共有電子対が他のフッ素原子から可能な限り離れているために、分子は直線を形成します。この形状を「線形」と呼びます。線状分子の結合角は 180 度です。 CO2 と BeH2 も線状分子です。
三角平面
BF3 は三方晶平面分子の例です。 BF3 には合計 24 個の価電子がある 分子。各フッ素原子が孤立電子対を他のフッ素原子からできるだけ遠ざけるために、分子は三角形の 2 次元形状を形成します。分子幾何学では、これは「三角平面」として知られています。三方晶平面分子の結合角は 120 度です。 CO3 (炭酸塩) は三方晶平面分子の別の例です。
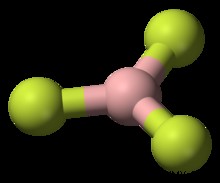
四面体
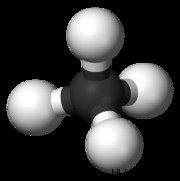
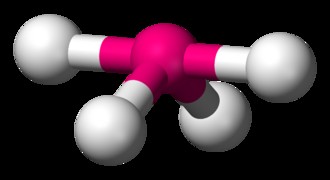
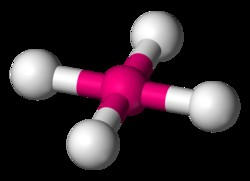
四面体分子の一般的な例は、CH4 です。 (メタン)。メタン分子には合計 8 つの価電子があります。 4 つの水素が互いに最も離れているために、四面体の形状に到達します。四面体は、正方形の平面ジオメトリの 3 次元表現です。四面体分子の H-C-H 結合角は 109.5 度です。
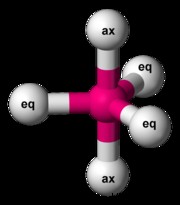
三角両錐
PF5 Trigonal Bipyramidal 分子の例です。 PF5 合計 38 個の価電子があります。各 P-F 結合は 2 つの価電子を使用し、各フッ素原子には 3 つの非共有電子対があります。 Phosphorus はそのオクテットを拡張できます。フッ素原子のうちの 3 つは、いわゆる赤道位置にあります。他の 2 つは、軸方向の位置と呼ばれるものにあります。赤道位置のフッ素が互いに可能な限り離れているようにするために、P-F 結合は互いに 120 度の角度にあり、赤道位置と軸位置の間の結合角度は 90 度です。
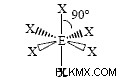
八面体
SF6 八面体分子の例です。 SF6 には 48 個の価電子があります 分子。各 S-F 結合は 2 つの価電子を占め、各フッ素原子は 3 つの非共有電子対を運びます。硫黄はそのオクテットを拡張できます。八面体の角にそれぞれを配置することで、フッ素原子間の反発を最小限に抑えることができます。
中心原子に孤立電子対を持つ分子の VSEPR 理論
曲がった
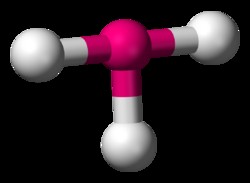
H2 Oは曲がった分子の例です。分子の中心原子に孤立電子対がある場合、これらの孤立電子対は中心原子に根ざした結合を反発します。水分子では、酸素原子の孤立電子対が水素結合を 2 次元空間で下向きにします。水素原子間の結合角は 104 度です。
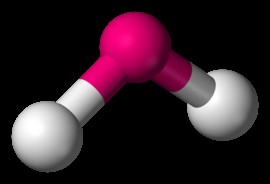
三角錐
NH3 三方錐体分子の例です。アンモニア分子では、中央の窒素原子の孤立電子対が、電子-電子反発力により、3 つの N-H 結合を下方に押します。
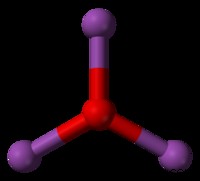
シーソー
SF4 シーソー形状の分子の例です。 SF4で 分子では、2 つの S-F 結合が赤道面で互いに向かい合って位置しています。他の 2 つの S-F 結合は、3 次元空間で互いに離れる方向を向いています。これにより、中心の硫黄原子に孤立電子対があることを考えると、フッ素原子が互いに最大の距離になることができます。この孤立したペアは、曲がったまたは三角錐のジオメトリのように、S-F 結合を押しのけます。
T型
BrF3 は、T 字型分子の例です。 BrF3 で 分子では、臭素の中心原子に 2 つの非共有電子対があり、他の構造よりも Br-F 結合でより極端な電子間反発を強制します。この形状は、T 字型分子に固有の 86.2 度の結合角を形成します。
四角錐
BrF5 で 分子、ジオメトリは八面体ジオメトリによく似ています。唯一の違いは、四角錐のジオメトリでは、軸原子の 1 つが孤立電子対に置き換えられることです。
正方形の平面
正方形の平面分子 XeF4 では 、形状は四角錐の形状によく似ていますが、そのために、軸結合が別の孤立電子対に置き換えられています.これにより、4 つの Xe-F 結合すべてが平面状の赤道配置に押し込まれます。
斧法
AX メソッドは、分子構造を表現する別の方法です。 AX モデルでは、A は中心原子を表します。 X は中心原子を表し、X は中心原子に接続された単結合の数を表し、E は中心原子にある孤立電子対の数を表します。
| AX | リニア |
| AX3 | 三角平面 |
| AX2 E | 曲がった |
| AX6 | 八面体 |
| AX5 | 両錐体 |
| AX4 | 四面体 |
| AX3 E | ピラミッド型 |
| AX3 E2 | シーソー |
| AX3 E2 | T型 |
| AX5 E | 四角錐 |
| AX4 E2 | 正方形平面 |
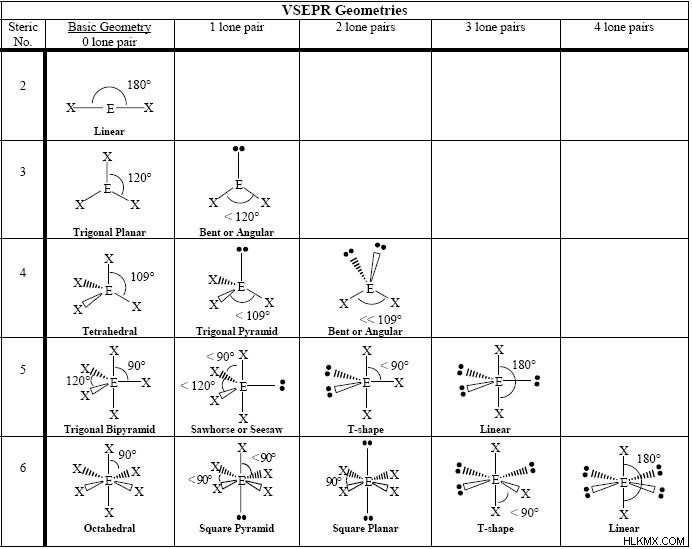
VSEPR チャートと立体数
この VSEPR チャートは、すべての一般的な VSEPR ジオメトリを示しており、立体数と孤立電子対の数で整理されています。立体数は、分子の中心原子に結合している原子の数に、その原子に結合している孤立電子対の数を加えたものです。価電子殻電子対反発理論で分子構造を見つけるために使用されます。
VSEPR 理論の実際の応用
一部の分子の化学的性質は、その幾何学的構造を反映していることが多く、VSEPR は、特定の分子の構造について知識に基づいた主張を行うための最良の方法です。
分子構造によって示されることが多い特性には、極性、色、反磁性/常磁性、生物活性などがあります。幾何学的構造はまた、化学者や他の科学者が分子を編成する生産的な方法を提供します。
VSEPR 理論のまとめ
原子価殻電子対反発理論は、分子の形状を予測する方法です。これは、電子が類似の電荷のために互いに反発し合い、孤立電子対間の距離が可能な限り大きくなるように分子が構築されるという核となる概念に基づいています。ほとんどの素分子は 11 の異なる形状カテゴリに適合することができ、価電子の数を知り、中心原子を認識し、VSEPR 理論を使用するだけで、これらを正確に予測できます。