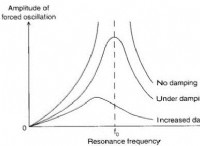
Δu=q -w
どこ:
* Δu システムの内部エネルギーの変化を表します。
* q システムに追加される熱を表します。
* w システムによって行われた作業を表します。
説明:
* 内部エネルギー(u): これは、その分子の運動エネルギーやポテンシャルエネルギーを含むシステム内に含まれる総エネルギーです。
* heat(q): これは、温度差のためにシステムとその周囲の間に伝達されるエネルギーです。
* work(w): これは、距離にわたって作用する力により、システムとその周囲の間に伝達されるエネルギーです。
キーポイント:
*熱力学の最初の法則は、エネルギーを作成または破壊することはできず、転送または変換されるだけであると述べています。
*方程式は、システムの内部エネルギーの変化がシステムに加えられた熱に等しく、システムによって行われた作業を差し引いていることを表しています。
*システムに熱が加えられた場合(q> 0)、内部エネルギーが増加します(Δu> 0)。
*システムがシステムによって行われた場合(w> 0)、内部エネルギーが減少します(Δu<0)。
注:
*使用される定義に応じて、作業の標識慣習を逆転させることができます。一部のソースは、システム *で行われた作業 *を肯定的であると定義していますが、他のソースは、システムをポジティブであると定義します。
*熱力学の最初の法則は、物理学の基本原則であり、工学、化学、生物学を含むさまざまな分野で広範囲の用途を持っています。