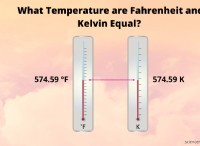
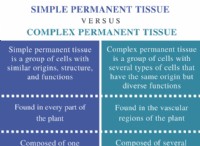
1。概念を理解する:
* エネルギーレベル: 原子の電子は、主要な量子数(n)で指定された特定のエネルギーレベルに存在します。 より高いエネルギーレベルは、nのより大きな値に対応しています。
* 遷移: 電子がより高いエネルギーレベルから低いエネルギーレベルに移行すると、光の形でエネルギーを放出します。放出された光のエネルギーは、2つのレベルのエネルギー差に対応します。
2。 Rydberg式:を使用します
Rydbergの式は、放出光の波長(λ)を、遷移に関与するエネルギーレベルに関連付けています。
1/λ=r(1/n₁² -1/n₂²)
どこ:
* rはRydberg定数です(約1.097 x10〜m⁻¹)
*n₁はエネルギーレベルが低い(最終状態)
*n₂はより高いエネルギーレベル(初期状態)です
3。値を差し込む:
この場合、n =2およびn =3。これらの値をRydberg式に置き換えます。
1/λ=(1.097 x10⁷m⁻¹)(1/2² -1/3²)
4。波長を解く:
* 1/λ=(1.097 x10⁷m⁻¹)(1/4-1/9)
* 1/λ=(1.097 x10⁷m⁻¹)(5/36)
*λ=36 /(5 * 1.097x10⁷¹)
*λ≈6.56x10⁻⁷m
5。ナノメートル(nm)に変換:
*λ≈656nm
したがって、水素電子がn =3からn =2に低下すると放出されるエネルギーの波長は約656 nmです。 これは、可視スペクトルの赤色光に対応します。