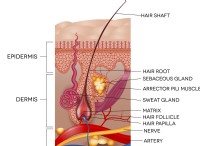
1。エネルギーレベル:
*原子の電子は、はしごのラングのような特定のエネルギーレベルでのみ存在します。これらのレベルは量子化されています。つまり、特定の個別の値しか持たないことを意味します。
*最低のエネルギーレベルは基底状態と呼ばれます。より高いエネルギーレベルは励起状態と呼ばれます。
2。励起:
*電子が(熱、光、またはその他のソースから)エネルギーを吸収すると、より高いエネルギーレベルにジャンプします。このプロセスは励起と呼ばれます。
3。励起解除:
*励起電子は不安定であり、より低いエネルギー状態に戻りたいと考えています。そうするために、光子(光の粒子)の形で吸収されたエネルギーを放出します。
*光子のエネルギーは、励起状態と基底状態のエネルギーの違いに正確に等しくなります。
4。光子放出:
*放出された光の周波数(したがって色)は、2つのレベルのエネルギー差によって決定されます。
*エネルギーの違いが高いと、周波数(青)光が高くなります。
*エネルギーの差が低いと、周波数(赤)光が低くなります。
5。電磁スペクトル:
*異なる原子は異なるエネルギーレベルの間隔を持ち、光の特定の波長(色)の放出につながります。これが、独自のスペクトル「指紋」によって要素を識別できる理由です。
要約:
励起電子がより低いエネルギーレベルに低下し、エネルギーの差を光子として放出すると、光が放出されます。光子のエネルギー、したがって光の色は、遷移に関与する特定のエネルギーレベルによって決定されます。