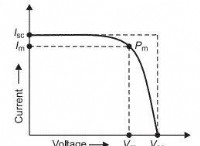
* エネルギーレベル: 原子には、電子が占めることができる特定のエネルギーレベルがあります。基底状態は最も低いエネルギーレベルです。より高いエネルギーレベルは励起状態と呼ばれます。
* エネルギー遷移: 電子がより高いエネルギーレベルから低いエネルギーレベル(基底状態を含む)に移行すると、エネルギーの違いが解放されます。
* 光子放出: このエネルギーの違いは、光の光子としてしばしば放出されます。光子のエネルギーは、光の周波数(したがって色)に直接関連しています。
放出されるエネルギーを決定するには、知っておく必要があります:
1。電子の初期エネルギーレベル: これにより、電子が始まるエネルギーがわかります。
2。基底状態のエネルギー: これにより、電子が終わるエネルギーがわかります。
エネルギーの計算:
放出されたエネルギー(ΔE)は、初期エネルギーレベル(E_INITIAL)から基底状態エネルギー(E_Ground)を減算することによって計算されます。
ΔE=e_initial -e_ground
例:
5 eV(電子電圧)のエネルギーが0 eVのエネルギーを持つ基底状態に遷移する励起状態の電子を想像してください。放出されるエネルギーは次のとおりです。
ΔE=5 eV -0 eV =5 eV
このエネルギーは、5 eVに対応する特定の周波数(したがって色)を持つ光子として放出されます。
キーポイント:
*電子の遷移中に放出されるエネルギーは量子化されています。つまり、特定の値のみを引き受けることができます。
*エネルギーレベルと遷移は、各原子と要素に固有のものです。
*このプロセスは、原子が光と相互作用する方法の基本であり、原子分光法のような現象につながります。
さまざまな要素の特定の例や計算を調べたい場合はお知らせください!