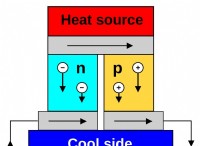
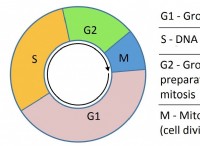
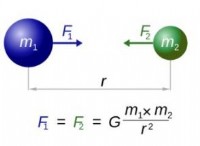
*軌道の電子は静的ではありません: 彼らは絶えず核の周りを動き回っており、確率雲を生み出しています。
* Hundのルール: この規則では、電子は同じ軌道でペアになる前に(Pサブシェルのような)サブシェル内で各軌道を個別に占有することを示しています。これは、電子が反発を最小限に抑えるために可能な限り離れていることを好むためです。
* パウリ除外原理: 原子内の2つの電子は、4つの量子数(スピンを含む)の同じセットを持つことはできません。これは、各p軌道が最大2つの電子を保持できることを意味しますが、反対のスピンが必要です。
* エネルギーレベル: サブシェル内のp軌道は縮退している(同じエネルギーを持っている)ため、電子は別の軌道よりも1つのp軌道を好まない。
本質的に、p軌道での電子の配置は、これらの基本原則の結果であり、特定の「力」のバランスの結果ではありません。