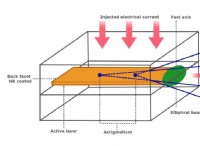
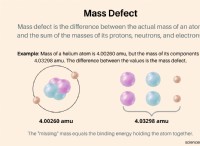
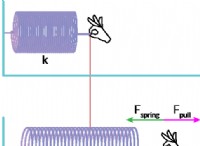
その理由は次のとおりです。
* 非金属 その原子価電子に強い魅力を持っています。それらは小さな原子半径と高い効果的な核電荷を持っています。つまり、核がより強く外側の電子を引っ張ることを意味します。
* 金属 一方、比較的ゆるく結合された価電子電子があります。これは、より大きな原子半径と効果的な核電荷が弱いため、原子価電子を除去しやすくなっているためです。
電子親和性のこの違いは、元素のイオン化エネルギーに反映されています。
* 高イオン化エネルギー: 非金属は、しっかりと保持された価電子電子を除去するために多くのエネルギーが必要なため、高いイオン化エネルギーを持っています。
* 低イオン化エネルギー: 金属は、ゆるく保持されている原子価電子を除去するのにエネルギーが少ないため、イオン化エネルギーが低いです。
例:
* イオン化エネルギーが高い非金属: フッ素(F)、酸素(O)、窒素(N)
* イオン化エネルギーが低い金属: ナトリウム(NA)、カリウム(K)、カルシウム(CA)
この一般的な傾向には、特に周期表のグループと期間内に例外があることを忘れないでください。ただし、一般的な原則は当てはまります。非金属は、価電子電子を強く保持する傾向があります。