熱からのエネルギーが、水分子間の水素結合を破壊するのに十分な大きさになると、水が沸騰します。沸騰したお湯から放出されるガスは、酸素と二酸化炭素で構成されています。
水を沸騰させたことがある人なら、水が熱くなると非常に小さな泡が形成され、底から上に上がることに気付くでしょう。最初は泡はほとんどありませんが、水が熱くなるにつれて、より大きなサイズの泡が形成され始めます。熱をさらに上げると、より大きな泡が頻繁に形成され、すぐに上に上がります。このエスカレーションは、水が沸騰し始めるとピークに達します。
しかし、なぜ熱湯は泡を作るのでしょうか?
その答えは、水自体の化学に関係しています。より具体的には、水に溶解しているすべての物質と、水分子間の結合の性質に関係しています。
水分子の化学的性質
水の各分子は、2 つの水素 (H) 原子と 1 つの酸素 (O) 原子で構成されています。両方の H 原子は、唯一の O 原子に共有結合しています。自然界のあらゆる要素は、可能な限り低いエネルギーの状態に到達しようと努力しています。この状態は、電子を失ったり獲得したりして、最も近い希ガス配置に到達することによって達成されます。
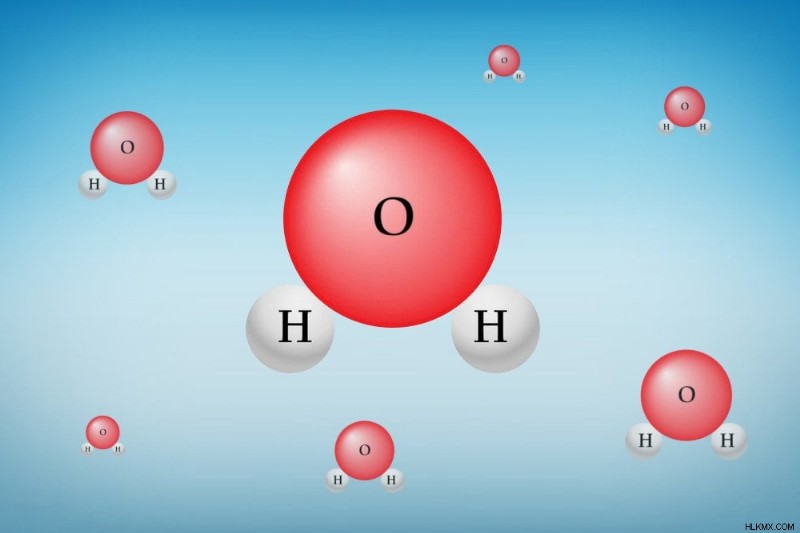
水分子のイラスト
酸素原子は、原子価 (最外殻) の殻に 6 つの電子を持っています。最も近い希ガスであるネオンは、原子価殻に 8 個の電子を持っています。したがって、Oは2つの電子を獲得して安定した電子配置を達成する(最低エネルギー状態に入る)強い傾向があります。水素はその原子価殻に 1 つの電子を持っていますが、最も近い希ガスであるヘリウムはその原子価殻に 2 つの電子を持っています。したがって、H は 1 つの電子を獲得して安定した電子配置を達成する傾向があります。
両方の H 原子はそれぞれ O と電子を共有しますが、O は各 H に 1 つずつ、2 つの電子を共有します。これは共有結合です。酸素は、電気陰性度と呼ばれる特性により、共有電子をそれ自体に引き寄せる強い傾向があります。したがって、電子は H 原子よりも O 原子の近くで多くの時間を過ごすため、O では部分的に負の電荷が、H では部分的に正の電荷が生じます。
水分子の形状は、電荷が相殺されないようになっており、電荷中心の分離 (分極) があります。わずかに分極した 2 つの水分子が互いに近づくと、一方の分子の部分的に負の O が、他方の分子の部分的に正の H を引き付けて、弱い分子間結合を形成します。これは水素結合と呼ばれ、水分子を結合する力です。

水素結合の可視化。
水素結合が弱いため、水は室温で液体のままであり、温度が上昇すると、分子は分子間水素結合を克服するためにより多くのエネルギーを獲得します。 100oC では、分子が自由に壊れるのに十分なエネルギーです。
水に溶解した物質
ある物質の別の物質への溶解は、2 つの物質の分子間に相互作用がある場合にのみ可能です。同様に、O2、CO2、N2、NH3、SO2 などの一部のガスは、水分子とガス分子の間に引力相互作用が存在するため、水に溶解します。
気体が水に溶ける方法には、ファン デル ワールス結合と水素結合の 2 つがあります。
NH3 や CO2 のような異核分子 (つまり、異なる元素の原子を持つ分子) は、原子間に電気陰性度の違いがあります。 N と O は、それぞれ H と C よりも電気陰性度が高くなります。したがって、N と O は部分的に負のままで、H と C は部分的に正になります。これにより、NH3 と CO2 分子の部分分極が発生します。
負の端 (N と O) は、水の部分的に正の H に引き寄せられます。一方、正の端 (H と C) は水の部分的に負の O に引き付けられます。これが水素結合です。気体分子の分極が大きいほど、水によく溶けます。
O2 や N2 のような等核分子 (つまり、同じ元素の原子を持つ分子) は無極性で、水に溶けにくい (非常に低い溶解度) です。弱いファン デル ワールス引力により、これらのガスは水分子と一緒に保持されます。これらは、双極子間相互作用よりもはるかに弱いです。
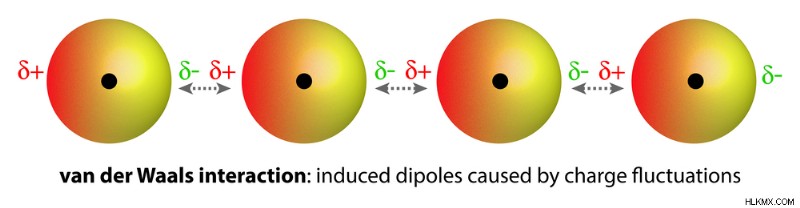
弱いファン デル ワールス力は、原子の周りの電荷電子分布の変化により発生し、一時的な誘導分極をもたらします。 (写真提供:magnetix/Shutterstock)
水への気体の溶解度は、温度が上昇するにつれて減少します。
水が沸騰するときの一連のイベント
常温(25℃)の液体の水をとりましょう。この温度で、O2 の溶解度は 8.27 mg/L、CO2 の溶解度は 1.5 g/L です。温度が上昇すると、気体と水の分子はより多くの運動エネルギーを獲得します。このエネルギーにより、すべての分子が分子間引力に打ち勝つことが容易になります。 50oC では、O2 の溶解度は 2.75 mg/L に減少し、CO2 の溶解度は 0.75 g/L に減少します。この溶解度の低下は、気体分子が弱い分子間引力を克服できることを意味します。 気体分子は水よりも密度が低いため、泡として上に上がります .ファンデルワールス力が弱いため、N2 や O2 などの等核分子は低温で泡立ちます。さらに温度を上げると、双極子間相互作用によって保持されている CO2 や NH3 などの極性分子が泡立ちます。

水から泡立つガス分子。 (写真提供:Egoreychenkov Evgenii/Shutterstock)
この泡立ちは水の沸点に達するまで続きます。水の加熱は完全に均一ではなく、温度が高い部分と低い部分があります。 90oC を超える温度では、底近くの一部の水分子が十分なエネルギーを獲得して気相に移行します。ガス状の水の領域が形成されます。これは、底から立ち上がる巨大な泡によって示されます。また、分子の活発な運動により、対流加熱によりさらに温度が上昇します。 100oC では、ほとんどすべての水分子が気相に移行するのに十分な運動エネルギーを持ち、水蒸気の泡が急速に上昇し始めます!