主な違い - アルファ アミラーゼとベータ アミラーゼ
アミラーゼ酵素の作用により、デンプンを糖単位に加水分解できます。アミラーゼは、人間や他の哺乳類の唾液や膵臓に自然に存在し、そこで食物ボーラス消化の生化学的プロセスを開始します。唾液アミラーゼがデンプンの一部を糖に分解するため、経口消化中、デンプン食品 (米、パン、ヤムイモ、ジャガイモ) はやや甘い味がします。アミラーゼは、1833 年に Anselme Payen によって最初に発見され、分離されました。アミラーゼ酵素は、アルファ (α)-アミラーゼ、ベータ (β)-アミラーゼ、およびガンマ (γ)-アミラーゼを含むさまざまなギリシャ文字によって具体的に命名されています。これらの酵素はすべてグリコシド加水分解酵素であり、α-1,4-グリコシド結合に作用します。 アルファ (α)-アミラーゼは主要な消化酵素であると考えられていますが、ベータ (β)-アミラーゼは種子の発芽と果実の成熟に関与する主要な酵素であると考えられています。しかし、ベータ (β)-アミラーゼおよびガンマ (γ)-アミラーゼと比較すると、α-アミラーゼ (EC 3.2.1.1) はカルシウム金属酵素であり、カルシウムの非存在下では機能できません。 これが 主な違い です アルファアミラーゼとベータアミラーゼの間。しかし、アルファ アミラーゼとベータ アミラーゼの両方が、デンプン由来の糖から調製されたビールや酒の醸造などの発酵プロセスで商業的に使用されています。この記事では、アルファ アミラーゼとベータ アミラーゼの違いをさらに詳しく説明しましょう.
この記事では、
1.アルファアミラーゼとは何ですか? – 定義、機能、特性、特性
2.ベータアミラーゼとは何ですか? – 定義、機能、特性、特性
3.アルファアミラーゼとベータアミラーゼの違いは何ですか? – 物理的および機能的特性の比較

アルファ アミラーゼとは
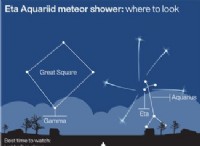
アルファ アミラーゼは、哺乳類の消化管における主要な消化酵素と考えられています。ヒトの唾液アミラーゼおよび膵臓アミラーゼは、α-アミラーゼおよび植物、菌類 (子嚢菌 および担子菌 ) とバクテリア (バチルス ) も α-アミラーゼを生成することができます.
アルファ アミラーゼの最適な pH は 6.7 ~ 7.0 です。カルシウムは、α-アミラーゼの機能に不可欠です。したがって、それはカルシウム金属酵素として知られています。アルファ アミラーゼは、デンプン アミロースなどの長鎖炭水化物をマルトトリオースとマルトースに分解したり、アミロペクチンをマルトース、グルコース、制限デキストリンに分解したりできます。
ヒト唾液α-アミラーゼのリボン図
ベータアミラーゼとは
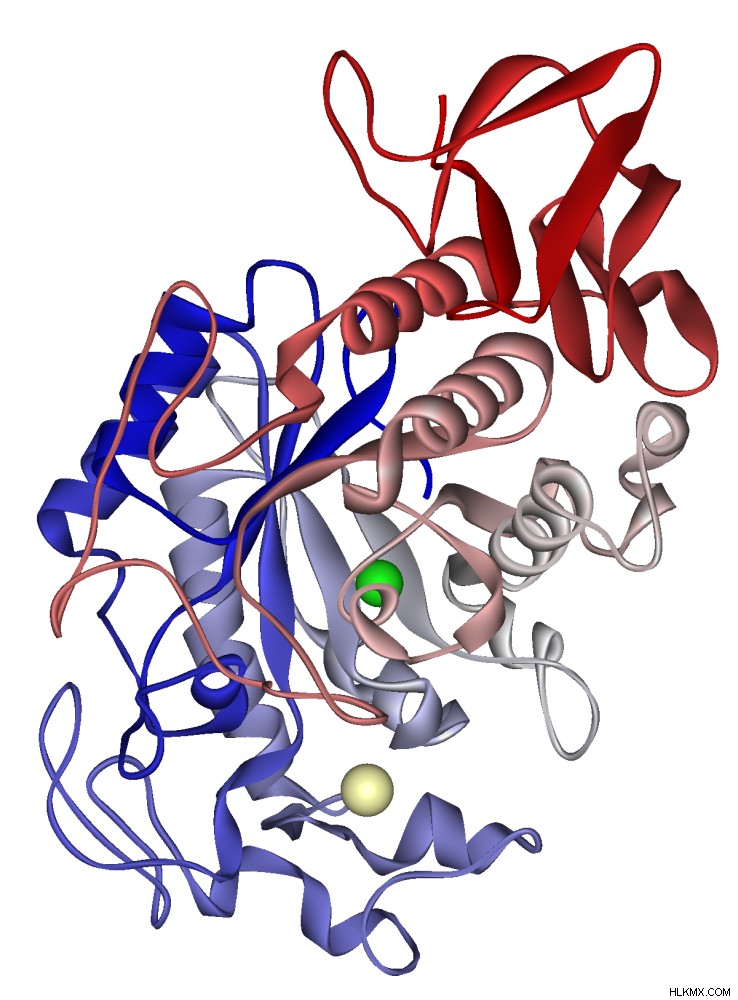
ベータ アミラーゼは、主にバクテリア、菌類、植物によって生成され、非還元糖の 2 番目の α-1,4 グリコシド結合の酵素的分解を触媒し、切断します。一度にマルトース。 β-アミラーゼがでんぷんを麦芽糖に分解し、熟した果実のような甘い香りがします。 β-アミラーゼの機能に最適な pH は 4.0 ~ 5.0 です。動物はβ-アミラーゼを産生しません。
大麦ベータアミラーゼのリボン図
アルファアミラーゼとベータアミラーゼの違い
アルファ アミラーゼとベータ アミラーゼは、物理的および機能的特性が大きく異なります。これらは次のサブグループに分類できます。
別名
アルファ アミラーゼ: 1,4-α-D-グルカン グルカノヒドロラーゼおよびグリコゲナーゼは、α-アミラーゼの別名です。
ベータ アミラーゼ: 1,4-α-D-グルカン マルトヒドロラーゼ、グリコゲナーゼ、およびサッカロゲン アミラーゼは、β-アミラーゼの別名です。
EC番号
アルファ アミラーゼ: EC 3.2.1.1
ベータ アミラーゼ: EC 3.2.1.2
生産
アルファ アミラーゼ: 哺乳類の消化器系はα-アミラーゼを合成できます。したがって、ヒトの唾液および膵臓のアミラーゼはα-アミラーゼです。さらに、α– アミラーゼは、植物、菌類 (子嚢菌と担子菌)、および細菌 (バチルス) によって生成されます。
ベータ アミラーゼ: β-アミラーゼは、細菌、真菌、および植物によって産生されます。動物の組織や細胞は、消化管内に存在する微生物に存在する可能性がありますが、β-アミラーゼを産生することはできません.
カルシウムの役割
アルファ アミラーゼ: カルシウムはα-アミラーゼの機能に不可欠であるため、カルシウム金属酵素として知られています.
ベータ アミラーゼ: β-アミラーゼの機能にカルシウムは必要ありません。
至適pH
アルファ アミラーゼ: β-アミラーゼの至適pHは6.7~7.0です
ベータ アミラーゼ: β-アミラーゼの至適pHは4.0~5.0です
主な機能
アルファ アミラーゼ: α-アミラーゼは、主に食物の消化プロセスに関与しています。
ベータ アミラーゼ: β-アミラーゼは、主に果実の成熟と種子の発芽プロセスに関与しています。
代理サイト
アルファ アミラーゼ: α-アミラーゼは、基質のどこにでも作用できます。
ベータ アミラーゼ: β-アミラーゼは非還元末端から作用し、2 番目の α-1,4 グリコシド結合の加水分解を触媒します
酵素反応の主な成果
アルファ アミラーゼ: 長鎖炭水化物 (アミロースとアミロペクチン鎖) は α-アミラーゼによって分解され、アミロースからマルトトリオースとマルトース、またはアミロペクチンからマルトース、グルコース、限界デキストリンを生成します
ベータ アミラーゼ: 果実が成熟する過程で、デンプンはβ-アミラーゼによってマルトースに分解され、熟した果実の甘い風味が生じます.
反応率
アルファ アミラーゼ: α-アミラーゼは、β-アミラーゼよりも速く作用する傾向があります.
ベータ アミラーゼ: β-アミラーゼは、α-アミラーゼよりも作用が遅い傾向があります.
物理的および化学的性質
アルファ アミラーゼ: α-アミラーゼは、高温や重金属イオンの影響を受けず、低い pH では不活化されます。
ベータ アミラーゼ: β-アミラーゼは高温と重金属イオンに敏感で、低い pH で安定です。
結論として、アミラーゼはデンプンをより小さな分子に加水分解できる酵素です。しかし、α-アミラーゼは活動に Ca を必要とし、最終生成物としてグルコース、マルトトリオース、およびマルトースを生成します。対照的に、β-アミラーゼはCaを必要とせず、可溶性デンプンまたはアミロースを加水分解し、最終生成物としてマルトースのみを生成します.
参考文献
Frydenberg、O および G. Nielsen。 1965. オオムギ種子の発芽におけるアミラーゼアイソザイム。 Hereditas 54:123-129.
Onckelen、H. A.、R. Verbeek。 1969年。オオムギの発芽中のα-アミラーゼアイソザイムの形成。プランタ 88:255-260.
Rejzek, M.;スティーブンソン、CE。サウザード、AM。スタンレー、D.; Denyer、K。スミス、AM。 Naldrett、MJ。ローソン、DM。フィールド、RA(2011)。 「化学遺伝学と穀物デンプン代謝:オオムギβ-アミラーゼの非共有結合および共有結合阻害の構造的基礎」。分子バイオシステムズ。 7 (3):718–730.