ヘモグロビン (Hb) は、赤血球に含まれる金属タンパク質です。赤血球は酸素を全身に運びます。魚を除くすべての脊椎動物は、酸素運搬体として赤血球にヘモグロビンを持っています。ヘモグロビンは赤血球の乾燥重量の 96% を構成し、鉄を含んでいます。人間の体にはすべてヘモグロビンが含まれています。正常な成人男性の正常なヘモグロビン レベルは 13.8 ~ 17.2 g/dL です。成人女性 (妊娠していない) のヘモグロビン値は 12.1 ~ 15.1 g/dL です。
この記事では、
1.ヘモグロビンの構造とは
2.人体におけるヘモグロビンの機能は何ですか
ヘモグロビンの構造とは
ヘモグロビンは、4 つのグロビン サブユニットが四面体構造に配置された四次構造を持つマルチサブユニットの球状タンパク質です。各球状タンパク質サブユニットには、非タンパク質の補欠ヘム基に関連するタンパク質鎖が含まれています。グロビンタンパク質のαヘリックス構造は、ヘム基を結合するポケットを作ります。グロビンタンパク質は、サイトゾルのリボザイムによって合成されます。ヘム部分はミトコンドリアで合成されます。荷電した鉄原子は、鉄と同じ平面内の 4 つの窒素原子との共有結合によって、ポルフィリン環に保持されます。これらの N 原子は、4 つのグロビン サブユニットのそれぞれの F8 ヒスチジン残基のイミダゾール環に属します。ヘモグロビンでは、鉄は Fe として存在します。
人体には、ヘモグロビン A、ヘモグロビン A2 の 3 種類のヘモグロビンがあります。 、およびヘモグロビン F。ヘモグロビン A が最も一般的なタイプです。ヘモグロビン A は HBA1 によってエンコードされます 、HBA2 、および HBB 遺伝子。ヘモグロビン A の 4 つのサブユニットは、2 つの α サブユニットと 2 つの β サブユニット (α2 β2 )。ヘモグロビン A2 とヘモグロビン F はまれであり、それぞれ 2 つの α サブユニットと 2 つのδ サブユニット、および 2 つの α サブユニットと 2 つのγ サブユニットで構成されています。乳児のヘモグロビン型はHb F (α2 γ2 ).
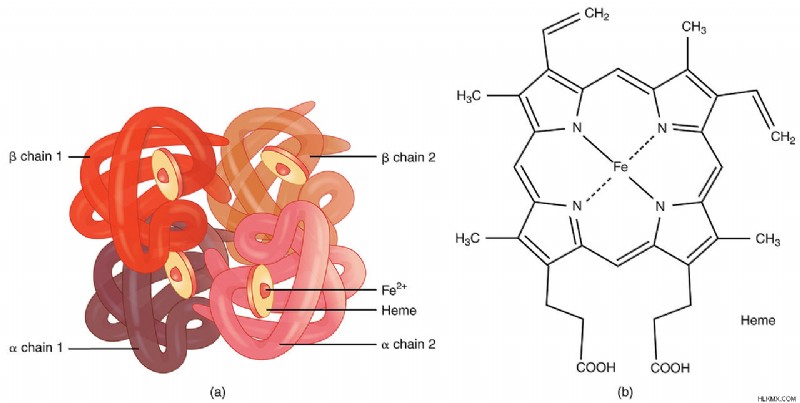
図 1:ヘモグロビンの構造
人体におけるヘモグロビンの機能とは
<オール>酸素運搬船
ヘモグロビンの主な機能は、肺から体のすべての組織への酸素の輸送です。ヘモグロビンの酸素結合容量は 1.34 mL O2 です。 グラムあたり。ヘモグロビン分子の各グロビン サブユニットは、1 つの Feion と結合できます。酸素に対するヘモグロビンの親和性は、Fe イオンによって得られます。各 Fe は 1 つの酸素分子と結合できます。酸素の結合により、Fe が Fe に酸化されます。 Fe に結合する酸素分子の 1 つの原子はスーパーオキシドになり、そこで他の酸素原子は斜めに突き出ます。酸素結合ヘモグロビンはオキシヘモグロビンと呼ばれます .血液が酸素欠乏組織に到達すると、酸素がヘモグロビンから解離し、組織内に拡散します。 O2 は、ATP の生成における酸化的リン酸化と呼ばれるプロセスにおける末端電子受容体です。 O2 の除去 鉄を還元型に変えます。酸素に結合していないヘモグロビンは、デオキシヘモグロビンと呼ばれます。 . Fe の Fe への酸化は、O2 と結合できないメトヘモグロビンを生成します。 .
二酸化炭素キャリア
ヘモグロビンはまた、二酸化炭素を組織から肺に輸送します。二酸化炭素の 80% はプラズマを介して輸送されます。二酸化炭素は、ヘモグロビンの酸素結合部位と競合しません。鉄結合位置以外のタンパク質構造に結合します。二酸化炭素結合ヘモグロビンは、カルバミノヘモグロビンと呼ばれます。 .
赤血球への影響
ヘモグロビンは Fe イオンによって赤血球に赤い色を与えます。赤血球があると、血液はその独特の赤い色に到達します。赤血球を含まない血漿は、淡い黄色をしています。赤血球の形はヘモグロビンによって保たれています。赤血球は、中央が平らでくぼんでいる両凹ディスクです。それらはダンベル型の断面を持っています。ヘモグロビン遺伝子も様々な対立遺伝子から構成されています。ほとんどの突然変異体は病気を引き起こさない可能性があります。しかし、一部の突然変異体は、ヘモグロビンパテシス などの遺伝性疾患を引き起こす可能性があります .
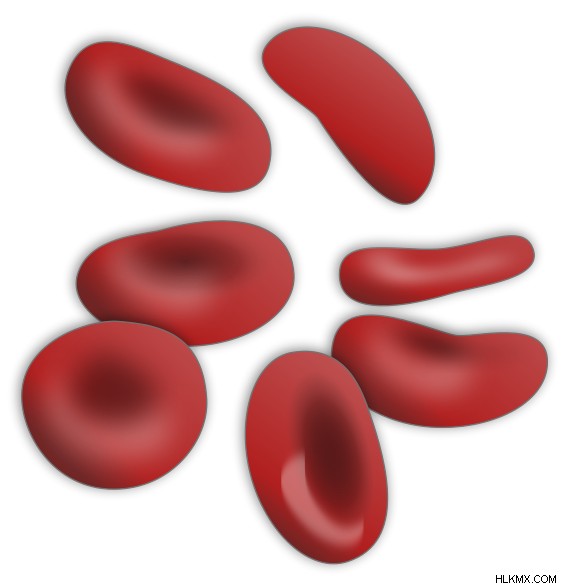
図 2:赤血球
バッファリング アクション
ヘモグロビンは血液の pH を 7.4 に維持します。血液中に二酸化炭素が蓄積すると、pHが7.4から低下します。 pH の変化は、換気によって元に戻すことができます。ヘモグロビンのこの緩衝作用により、この pH を好む体内のすべての酵素反応は、何の妨害もなく起こることができます。
リガンドとの相互作用
ヘモグロビンは、一酸化炭素、窒素酸化物、シアン化物、一酸化硫黄、硫化物、硫化水素などの他の配位子にも結合します。結合は不可逆的であるため、一酸化炭素の結合は時に致命的となる場合があります。ヘモグロビンは薬物を作用部位に運ぶこともできます。
生理活性カタボライトの生成
細胞の老化と欠陥により、赤血球が死滅し、さまざまな生理学的に活性な異化産物が蓄積されます。死んだ赤血球のヘモグロビンは、ヘモグリビン輸送体である CD163 によって循環から除去されます。単球およびマクロファージで発生するヘム分解は、一酸化炭素生成の自然な発生源です。 ビリルビン ヘム分解の最終産物です。胆汁として腸内に分泌されます。ビリルビンは糞便に含まれるウロビリノーゲンに変換され、独特の黄色を呈します。一方、ヘムから取り除かれた鉄はフェリチンに変換されます 後で使用するために組織に保存されます。
ヘモグロビンは、赤血球以外の体の細胞にも見られます。他のヘモグロビン運搬細胞は、マクロファージ、肺の肺胞細胞、腎臓のメサンギウム細胞です。ヘモグロビンは、これらの細胞で鉄代謝の調節因子および抗酸化物質として機能します。
参考:
1. "ヘモグロビン"。フリー百科事典ウィキペディア。 2017. 2017 年 2 月 15 日アクセス
2. Davis C. P. と Shiel W. C. 「ヘモグロビン」。 MedicineNet、2015.htm。 2017 年 2 月 15 日アクセス
3. 「ヘモグロビンの構造と機能」。 All Medical stuff, 2017. 2017 年 2 月 15 日にアクセス
画像提供:
1. 「1904 Hemoglobin」OpenStax College – Anatomy &Physiology、Connexions Web サイト。 2013 年 6 月 19 日。(CC BY 3.0) コモンズ ウィキメディア経由
2. 「赤血球」ジェシカ・ポルカ著– Commons Wikimedia経由の自作(CC BY-SA 4.0)