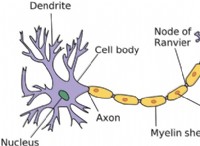
1。解離定数(kb): 解離定数(KB)は、ベースの解離強度の定量的尺度です。これは、水中の塩基の解離反応の平衡定数を表します。 KB値が高いほど、水酸化物イオンを解離および放出する塩基の傾向が大きく、より強力な塩基になります。
2。イオン電荷: ベースの陽イオンのイオン電荷も、その強度を決定する役割を果たします。より高い陽性電荷を持つカチオンは、塩基によって放出される水酸化物イオンの負の電荷を安定させる傾向があります。その結果、高度に帯電した陽イオンを備えた塩基は一般に強くなります。たとえば、KOH(水酸化カリウム)はNaOH(水酸化ナトリウム)よりも強い塩基です。これは、K+がNa+(+1)と比較して高い電荷(+1)を持っているためです。
3。イオンサイズ: ベースの陽イオンのイオンサイズは、ベースの強度に影響します。大きな陽イオンの電荷密度は低いため、水酸化物イオンとはあまり強く相互作用しません。このより弱い相互作用により、ベースはより広範囲に分離し、より強力なベースにつながります。たとえば、CSOH(水酸化セシウム)は、CS+がK+よりも大きく、電荷密度が低いため、KOHよりも強いベースです。
4。水分補給エネルギー: ベースの陽イオンの水和エネルギーもその強度に影響します。水和エネルギーとは、イオンが水分子に囲まれているときに放出されるエネルギーを指します。水分エネルギーが高いカチオンは、水分子により強く引き付けられ、水酸化物イオンとの相互作用が減少する傾向があります。その結果、水和エネルギーが高い陽イオンを持つ塩基は一般に弱くなります。
5。陰イオンの溶媒和: コンジュゲートベースの溶媒和(解離後に形成された陰イオン)も、塩基の強度に影響します。水分子によってより容易に溶媒されるアニオンはより安定しており、塩基の解離を支持し、その強度を高めます。
6。構造効果: ベースに存在する分子構造と官能基は、その強度に影響を与える可能性があります。電子吸引グループなどの特定の機能グループは、共役塩基を安定化することにより、塩基の解離を促進できます。
これらの要因を考慮することにより、Arrheniusベースの相対的な強さを理解して予測することができます。塩基の強度は、酸塩基反応、pH調節、触媒を含むさまざまな化学的および生物学的プロセスで重要です。