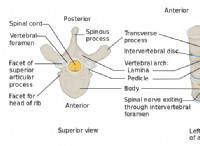
核: 核は原子の中心コアであり、正に帯電した陽子と荷電中の中性子が含まれています。核は非常に密度が高く、原子の質量のほとんどが含まれています。
電子: 電子は、シェルと呼ばれる固定経路で核を周回する負に帯電した粒子です。各シェルは特定の数の電子を保持でき、核から離れるとシェルの数が増加します。
電子シェル: 電子シェルには、文字k、l、m、nなどが付いています。 Kシェルは最も内側のシェルであり、最大2つの電子を保持できます。 Lシェルは最大8つの電子を保持でき、Mシェルは最大18電子などを保持できます。
電子サブシェル: 電子シェルはさらにサブシェルに分割され、文字s、p、d、およびfでラベル付けされています。 Sサブシェルは最大2つの電子を保持でき、Pサブシェルは最大6つの電子を保持でき、Dサブシェルは最大10電子を保持でき、Fサブシェルは最大14電子を保持できます。
電子構成: 原子の電子構成は、電子シェルとサブシェル内の電子の配置を記述します。電子構成は、シェル文字とサブシェル文字を使用して記述され、それに続いて各サブシェルに電子の数が続きます。たとえば、ヘリウムの電子構成は1S2です。つまり、ヘリウムにはSサブシェルの両方で、Kシェルに2つの電子があります。
原子のbohrモデルは、原子の基本構造と電子が核と相互作用する方法を理解するのに役立つ原子の単純化された表現です。