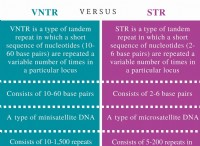
グラウンドナット葉からのゲノムDNAの分離:ステップバイステップガイド
このプロトコルは、単純で費用対効果の高いアプローチを使用して、グラウンドナット葉からゲノムDNAを抽出するための基本的な方法の概要を示しています。
材料:
*グラウンドナットの葉(新鮮または冷凍)
*液体窒素
*モルタルと乳棒
* 1.5 mlのマイクロアプリミックチューブ
* 100 mm Tris-HCl(pH 8.0)
* 25 mm EDTA(pH 8.0)
* 1.4 m NaCl
* 10%SDS(硫酸ナトリウム)
*クロロホルム:イソアミルアルコール(24:1)
*イソプロパノール
* 70%エタノール
* RNase A溶液(10 mg/ml)
*分光光度計
手順:
1。サンプル準備:
*新鮮または冷凍の粉砕葉を集めます。凍結した葉を使用する場合は、室温で解凍します。
*重量約0.1〜0.2 gの葉組織。
*葉を事前に冷やしたモルタルに入れ、液体窒素を使用して微粉末に粉砕します。
2。溶解:
*粉末葉を1.5 mLの微小遠心性チューブに移します。
* 500 µLの溶解バッファー(100 mM Tris-HCl、pH 8.0、25 mM EDTA、pH 8.0、1.4 M NaCl、および10%SDS)を加えます。
*チューブを65°Cで30分間インキュベートし、時折穏やかに揺れます。このステップは、細胞壁と膜を分解し、DNAを放出します。
3。タンパク質除去:
* 200 µLのクロロホルム:イソアミルアルコール(24:1)をチューブに加えます。
*チューブを10分間激しく振ってください。
*チューブを10,000 x gで室温で10分間遠心にします。このステップでは、溶液を3つの層に分離します:水層(上)、間期(中)、および有機層(下)。 DNAは水層にあります。
4。 DNA沈殿:
*水層を新しい1.5 mLの微小遠心性チューブに慎重に移します。
* 0.5容量のイソプロパノールをチューブに加え、穏やかに混ぜます。これにより、溶液からDNAが沈殿します。
*チューブを-20°Cで30分間インキュベートします。
*チューブを10,000 x gで4°Cで10分間遠心にします。 DNAペレットはチューブの底に形成されます。
5。洗浄と乾燥:
*上清を除去し、500 µLの70%エタノールでDNAペレットを洗浄します。
*チューブを10,000 x gで4°Cで5分間遠心にします。
*エタノールを取り外し、ペレットを5〜10分間空気乾燥させます。
6。再懸濁およびRNase処理:
* DNAペレットを50 µLのTEバッファー(10 mM Tris-HCl、pH 8.0、1 mm EDTA、pH 8.0)に再懸濁します。
* 1 µLのRNase A溶液(10 mg/ml)をチューブに加えます。
*チューブを37°Cで30分間インキュベートして、残りのRNAを除去します。
7。 DNAの定量化と品質チェック:
* 260 nmおよび280 nmの波長で分光光度計を使用して抽出されたDNAを定量化します。 260 nm/280 nmでの吸光度の比は1.8〜2.0でなければならず、純粋なDNAを示しています。
注:
*このプロトコルは基本的なガイドラインであり、DNAの特定の葉材料と望ましい品質に基づいて調整する必要がある場合があります。
*生物学的サンプルを処理するときは、常に手袋とラボのコートを着用してください。
*汚染を避けるために、すべての試薬と機器が不妊であることを確認します。
*市販のDNA抽出キットを使用して、より合理化された効率的なプロセスを使用することもできます。
さらなるアプリケーション:
*分離されたゲノムDNAは、以下を含むさまざまな分子生物学用途に使用できます。
* PCR(ポリメラーゼ連鎖反応)
* DNAシーケンス
*遺伝分析
*クローニング
このプロトコルは、グラウンドナットの葉からゲノムDNAを分離するためのシンプルで費用対効果の高い方法を提供し、さまざまな研究やアプリケーションへの道を開いています。