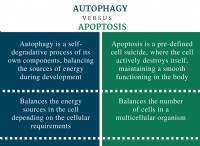
1。アミノ酸配列:
* 一次構造: これは、遺伝コードによって決定されるアミノ酸の線形配列です。アミノ酸の特定の順序は、タンパク質の最終形状の主要な決定要因です。
* r-Groups: 各アミノ酸のユニークな側鎖(Rグループ)は、タンパク質の全体的な形状と相互作用に寄与します。一部のRグループは疎水性であり、タンパク質の内部に埋葬されることを好みますが、他のグループは親水性であり、水性環境にさらされる傾向があります。
2。アミノ酸間の相互作用:
* 水素結合: 水素結合は、極アミノ酸と水の間、または異なる極アミノ酸の間に形成されます。
* イオン結合: これらは、反対に帯電したアミノ酸間で発生します。
* 疎水性相互作用: 非極性アミノ酸は、水との接触を避けるために一緒に集まっている傾向があり、タンパク質内に疎水性コアを作り出します。
* ジスルフィドブリッジ: システイン残基間の共有結合は、タンパク質構造を安定させる強力なリンクを生み出します。
3。環境要因:
* 温度: 高温は弱い結合を破壊し、タンパク質を変性させます(その形状を失います)。
* ph: 極端なpHはイオン結合を破壊し、アミノ酸の電荷に影響を与え、タンパク質の形状を変えます。
* 塩濃度: 高塩濃度もイオンの相互作用を破壊し、変性につながる可能性があります。
* 他の分子の存在: 補因子や基質などの他の分子の存在は、タンパク質の特定の部位に結合し、その形状に影響を与える可能性があります。
4。シャペロンタンパク質:
* 折りたたみ支援: これらのタンパク質は、保護環境を提供し、折りたたみプロセスを導くことにより、他のタンパク質が正しく折りたたまれます。
5。翻訳後の修正:
* 化学修正: リン酸化やグリコシル化などのこれらの修飾は、タンパク質の形状と機能を変える可能性があります。
タンパク質形状の結果:
* 特異性: タンパク質のユニークな形状により、基質、酵素、または他のタンパク質などの他の分子と特異的に相互作用することができます。
* 関数: タンパク質の形状は、その生物学的機能を決定します。たとえば、酵素には基質に適合する特定の活性部位があり、反応を触媒することができます。
* 安定性: タンパク質の正しい形状は、その安定性と変性に抵抗する能力にとって重要です。
タンパク質の形状が静的ではないことを理解することが重要です。それは動的であり、環境要因または他の分子との相互作用に応じて変化する可能性があります。この柔軟性は、タンパク質がその機能を実行するためにしばしば不可欠です。