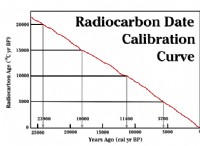
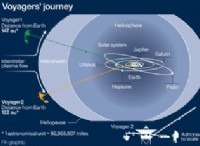
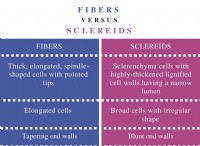
異なる酵素が最適なpHを持っている理由は次のとおりです。
* 水素結合: 溶液のpHは、酵素内のアミノ酸側鎖のイオン化の程度に影響します。これらの帯電したグループは、酵素の活性部位を安定化する水素結合を形成する上で重要な役割を果たします。 pHを変更すると、これらの水素結合が破壊され、活性部位の形状と活性が変化します。
* イオン相互作用: pHは、帯電したアミノ酸側鎖間の静電相互作用に影響を与える可能性があります。これらの相互作用は、酵素の全体的な構造と柔軟性を維持するために不可欠です。 pHのシフトは、これらの相互作用を弱めたり強化したりし、酵素の機能に影響を与えます。
* アクティブサイト化学: 活性部位には、多くの場合、触媒作用に重要な特定のアミノ酸残基が含まれています。これらの残基は、pHに応じてプロトン化または脱プロトン化することができます。たとえば、酸性の残基は、最適な触媒のために脱プロトン化する必要があるかもしれません。 pHを変更すると、これらの残基のイオン化状態が変化し、基質と相互作用して触媒反応に関与する能力に影響します。
* 基板結合: pHは、基質分子のイオン化状態にも影響を与える可能性があります。 これは、基質がアクティブサイトとどの程度うまく相互作用するか、および効率的に結合できるかどうかに影響を与える可能性があります。
要約:
異なる酵素は、その構造と活性部位が酸性度またはアルカリ度の変化に敏感であるため、最適なpHを持っています。 pHは、酵素内のアミノ酸、水素結合パターン、および静電相互作用のイオン化状態に影響を与え、最終的に酵素の触媒活性に影響を与えます。
ここにいくつかの例があります:
* ペプシン: この酵素は胃に見られ、最適なpHが約2.0で、これは非常に酸性です。これは、胃環境のタンパク質を分解するのに最適です。
* トリプシン: この酵素は小腸に含まれており、最適なpHは約8.0で、これはわずかにアルカリ性です。これは、タンパク質が胃の中で部分的に分解された後の消化に適しています。
ロックとキーのように考えてください: ロック(酵素)とキー(基質)の両方が、適合して適切に機能するには、適切な形状と環境である必要があります。 pHは、ロックとキーの両方の形状と環境に影響を与える重要な要因の1つです。