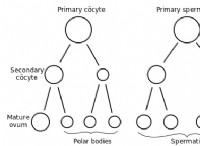
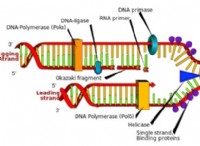
構造:
* コイルド: ポリペプチド鎖はばねのように巻き付けられており、アミノ酸残基はヘリックスの骨格を形成しています。
* 右利き: ヘリックスは通常、右利きであるため、標準のネジと同じ方向にひねります。
* ターンあたり3.6残基: ヘリックスの完全なターンごとに、約3.6アミノ酸残基が含まれます。
* 水素結合: ヘリックスは、1つのアミノ酸のカルボニル酸素と、鎖の4つの残基のアミノ酸4残基のアミノ水素の間に形成された水素結合によって安定化されます。これにより、ヘリックスに沿って水素結合の繰り返しパターンが作成されます。
プロパティ:
* コンパクトで安定した: らせん構造は比較的コンパクトで安定しているため、タンパク質の一般的な構造モチーフとなっています。
* 疎水性コア: アミノ酸の側鎖はヘリックスから外側に向かって指を向け、疎水性コアを作成します。
* amphipithic: 一部のアルファヘリックスは、親水性側と疎水性側を持つことができ、水と脂質の両方と相互作用することができます。
* 柔軟性: 安定していますが、アルファヘリックスは柔軟性があり、異なる立体構造を採用することができます。
関数:
アルファヘリックスは、幅広いタンパク質機能に関与しています。
* バインディングサイト: それらは、DNAや他のタンパク質など、他の分子の結合部位を形成できます。
* 構造的サポート: それらは、タンパク質に構造的なサポートと剛性を提供します。
* 膜貫通ドメイン: それらはしばしば膜タンパク質に膜貫通ドメインを形成し、細胞膜に及ぶことができます。
* 信号シーケンス: 一部のアルファヘリックスは信号配列として機能し、タンパク質をセル内の適切な位置に向けます。
例:
アルファヘリックスは、以下を含む多数のタンパク質に含まれています。
* ケラチン: 髪と皮膚に見られる繊維性タンパク質は、アルファヘリックスが一緒に巻かれていることで構成されています。
* ミオグロビン: 筋肉組織に酸素を運ぶタンパク質には、8つのアルファヘリックスが含まれています。
* ヘモグロビン: 血液中の酸素を輸送する原因となるタンパク質には、アルファヘリックスも含まれています。
要約すると、アルファヘリックスはタンパク質の基本的な二次構造であり、他の分子との安定性、機能、および相互作用に貢献しています。