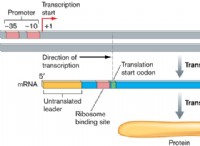
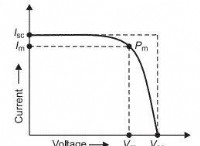
これが故障です:
* ベース 陽子(H+)を受け入れる物質です。
*塩基が水に溶けると、水分子と反応して水酸化物イオン(OH-)と共役酸を形成します。
* 共役酸 ベースがプロトンを受け入れるときに形成された種です。
例:
水酸化ナトリウム(NAOH)は強力なベースです。水に溶けると、ナトリウムイオン(Na+)および水酸化物イオン(OH-)に分離します。
naoh(aq)→na +(aq) + oh-(aq)
この場合、水酸化物イオン(OH-)は、水に溶解する塩基の産物です。
重要な注意:
塩基の強度は、水酸化物イオンを生成する程度を決定します。 NaOHのような強い基地は水中で完全に解離し、高濃度のOH-を生成します。アンモニア(NH3)のような弱い塩基は部分的にしか解離しないため、OH-の濃度が低くなります。