その理由は次のとおりです。
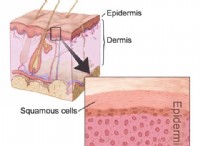
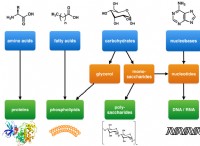
* pHおよび生物: 生物は、pHの変化に非常に敏感です。小さな変動でさえ、酵素活性や細胞機能などの重要な生物学的プロセスを破壊する可能性があります。
* pH調節因子としてのバッファ: バッファーは、少量の酸または塩基が追加されると、pHの変化に抵抗する溶液です。それらは、水素イオン(H+)を寄付または受け入れることができるコンポーネントを持つことで機能し、追加の酸または塩基を効果的に中和します。
* 例: 人体の一般的な緩衝液は、重炭酸塩緩衝液システムです。 炭酸酸(H2CO3)と平衡に重炭酸イオン(HCO3-)が関与します。このシステムは、過剰な水素イオン(酸)を吸収するか、塩基の増加に対抗するためにそれらを放出することができます。
要約すると、バッファーは生物内の安定したpH環境を維持するために不可欠であり、重要な生物学的プロセスが最適に機能することを可能にします。