反応における制限試薬 (または反応物) は、各反応物によって生成される生成物の量を計算することによって検出されます。最小量の生成物を生成する反応物が制限反応物です。
有用な生成物を生成する化学反応には、反応を取り巻く環境から存在する反応物の量まで、適切に行わなければならないことがたくさんあります。ブルームーンに一度だけ、すべての反応物が生成物に変換されます。
ほとんどの反応では、1 つの試薬 (試薬と反応物は交換可能に使用されます) が完全に枯渇しますが、他の試薬の一部はさらなる反応のために利用可能のままです。
反応物の 1 つが常に利用できるとは限らないため、反応は障害物にぶつかり、継続しません。完全に使い果たされ、反応の進行を制限するこの反応物は、制限反応物または制限試薬と呼ばれます。

化学反応における制限試薬は、生成される最終生成物の量を制御します。
制限反応物とは?
その量と役割に基づいて、反応物を次の 2 種類に分類します。制限反応物と過剰反応物 .
制限反応物は、最初に反応で完全に利用されるため、生成される生成物の量を制限するものです。一方、過剰な反応物は、反応が停止した後もまだ存在している反応物です。
お気に入りのベーグル ベンダーの列に並んでいるとします。ベーグル担当者がカートから出てきて、ベーグルが 10 個しか残っていないと発表しました。今、あなたは携帯電話から顔を上げて、自分の前に並んでいる人の数を数え始めます。合計 20 人を数えます。これは、残っているベーグルの数よりも 10 多い数です。
この例では、列に並んでいる顧客とベーグルは反応物であり、一緒になって幸せな個人 (最終製品) を生成します。
ただし、ベーグルの数は、最終的に達成できる幸せな顧客の数を制限し、それを制限要因 (エージェント) にしますが、顧客は過剰な反応物と見なされます。
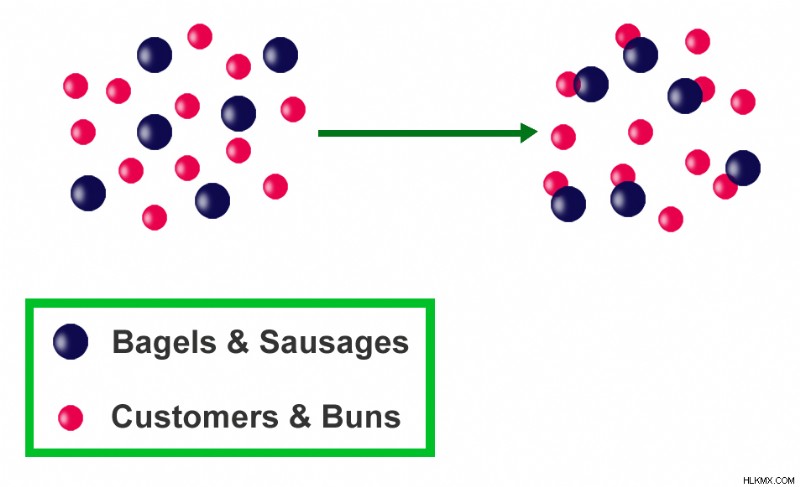
もう 1 つの例は、ホットドッグを作るのに必要なパンとソーセージの数です。ホットドッグを作るにはパンとソーセージの両方が必要です.アイテム (反応物) の数が等しくないと、ホットドッグ (製品) の数が不十分になります。バンズ 10 個とソーセージ 5 個の場合、ホットドッグは 5 個しか製造できず、残りのバンズは 5 個になります。パンは過剰に入手できますが、ソーセージは制限剤であり、作ることができるホットドッグの数を制御します.
制限反応物を見つける方法
反応における制限および過剰な反応物を決定する方法はいくつかあります。ただし、これらの方法には、バランスの取れた化学式を手に入れるという前提条件があります。
メソッドは、バランスの取れた化学式からの化学量論係数を使用して比率を計算します。係数自体が正しくない場合、得られる最終的な答えも正しくありません。
最初の方法では、反応物のモル比を見つけて比較しますが、他の方法では、各反応物によって生成される生成物の量を見つけます。最終生成物の生成量が最も少ないのが制限試薬です。
方法 1:モル比を使用する
この方法をアンモニア (NH3) と分子状酸素 (O2) の反応に適用して、2 つの制限反応物を見つけてみましょう。 NH3 と O2 の反応により、NO (一酸化窒素) と H2O (水) が生成されます。反応のバランスの取れた化学式は次のとおりです。
4NH3 + 5O2 → 4NO + 6H2O
この式は、4 モルのアンモニアが 4 モルの硝酸と 6 モルの水を生成するために 5 モルの酸素を必要とするものとして読み取られます。
まず、反応物の化学量論比を見つけることから始めます。これを行うには、各反応物の化学量論係数を単純に除算します。アンモニアの場合、化学量論係数は 4 ですが、酸素の場合は 5 です。
化学量論比 =4 モルのアンモニア / 5 モルの酸素 =0.8 モルのアンモニア / 1 モルの酸素
これは、酸素 1 モルごとに 0.8 モルのアンモニアが必要であることを意味します。
次に、反応物のモル比を求めます。ほとんどのシナリオでは、反応物の量はグラム単位で提供されます。グラム値をモルに変換し、制限反応物を見つける方向に進みます。アンモニアと酸素がそれぞれ 100 グラムあるとします。これをモルに変換するには、これらの値を分子量で割ります。
アンモニアの場合、モル数 =(100 g) / (17.04 g/mol) =5.86 mol
酸素の場合、モル数 =(100 g) / (32 g/mol) =3.125 mol
2 つの方法で先に進むことができます。 1 つは、制限反応物を想定し、必要な他の反応物のモル数を求める方法、または、実際の比率を見つけてその値から結論を引き出す方法です。最初の経路をたどり、アンモニアが制限反応物であると仮定しましょう。
アンモニアが最初に消費されると仮定すると、(5.86 モルのアンモニア) / 化学量論比 =4.688 モルの酸素が必要です。

しかし、反応に利用できる酸素は 3.125 モルしかないため、アンモニアより先に酸素が不足します。したがって、酸素が制限反応物であり、アンモニアが過剰に利用可能です。
方法 2:各反応物によって生成される生成物の量を比較することによって
前の方法と同様に、バランスのとれた化学式から始めて、各反応物のモル数を決定します。前の方法で見つかったものと同じ値を使用します。
アンモニアのモル数 =5.86 mol &酸素のモル数 =3.125 mol.
ここで、各反応物が生成する最終生成物 (NO) の量を見つけます。
アンモニアの場合、一酸化窒素 (NO) のモル =利用可能な NH3 のモル数 × NO の化学量論係数 / NH3 の化学量論係数 =5.86 × 4/4 =5.86 モルの NO
酸素の場合、一酸化窒素 (NO) のモル =利用可能な O2 のモル × NO の化学量論係数 / O2 の化学量論係数 =3.125 × 4/5 =2.5 モルの NO
酸素によって生成される生成物の量は、アンモニアによって生成される量よりも少ないため、酸素が制限反応物であり、アンモニアが過剰です。
最後の言葉
ご覧のとおり、反応の制限試薬または制限反応物は、完全に使い果たされ、反応が進行しなくなる反応物です。また、生産される最終製品の量も決定します。
制限反応物を見つけることは、反応の収率を求める上で重要なステップです。反応の収率は、実際の収率と理論上の収率の 100 を掛けた比率です。理論上の収率は、制限反応物が完全に反応すると仮定して、化学量論的計算によって予測される収率です。
簡単に言えば、制限反応物から生成される生成物の量です。私たちの場合、制限反応物は酸素であり、それから生成される生成物 (NO) の量は 2.5 モルです。したがって、反応の理論収量は 2.5 モルです。
実際の収量は、実験で得られた最終生成物の量です。実験で得られた実際の収量を 2 モルと仮定しましょう。パーセンテージ利回りは次のようになります:
パーセンテージ利回り =(実際の利回り/理論上の利回り) × 100 =(2/2.5) × 100 =80%
通常、計算された理論収量は、実際に生産される収量よりも高くなります。これは、反応の可逆性、望ましくない副生成物の生成、精製プロセスのエラーなど、さまざまな理由で発生します。