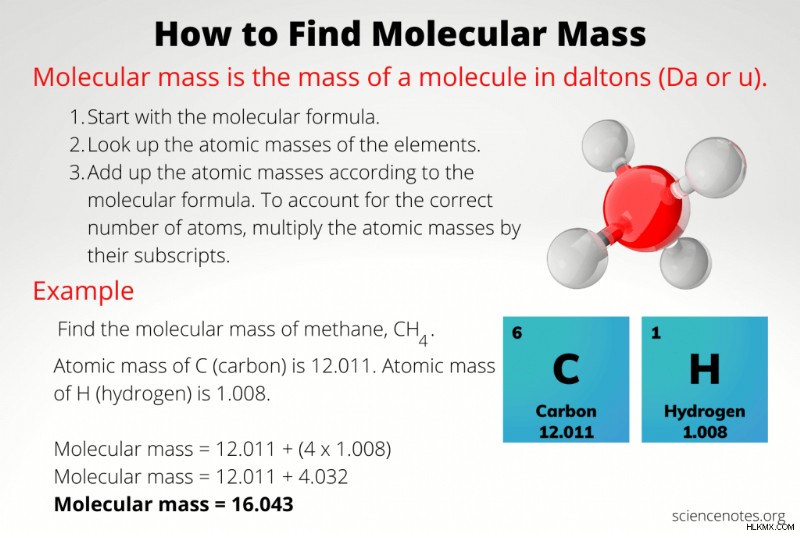
分子量 1分子の質量です。通常、分子量 (m) はダルトン (Da) 単位または原子質量単位 (amu または u) で報告されます。ここでは、分子量の求め方、計算例、分子量とモル質量の違いについて説明します。
- 分子または化合物の分子式を書いてください。
- 式中の各元素の原子量を調べる
- 各原子質量に式の添え字を掛けます。
- 各元素の原子質量を合計してください。
分子量の求め方
分子量を計算するには、分子を構成する原子の数と種類を知る必要があります。分子の原子構成がわかったら、周期表を使用して各原子の質量を見つけ、それらを足し合わせます。各元素の原子数は、分子式の添字です。元素記号の後に下付き文字がない場合、式にその元素の原子が 1 つあることを意味します。
たとえば、水の分子式は H2 です。 O. これは、1 つの水分子に 2 つの水素原子と 1 つの酸素原子が含まれていることを意味します。
周期表は、水素の原子質量が 1.0008 amu で、酸素の原子質量が 15.999 amu であることを示しています。水の分子量は、水素の 2 つの質量に酸素の質量を加えたものになります。
H2 の分子量 O =(2 x 1.008 amu) + (15.999 amu)
H2 の分子量 O =2.016 amu + 15.999 amu
H2 の分子量 O =18.015 amu
水の分子量は 18.015 amu です。
1 amu は 1 グラム/モルに相当することを忘れないでください。これは、分子の分子量を見つける方法です。これは、水 1 モルの重さが 18.015 グラムであることを意味します。
分子量の計算例
例:
硫酸の分子量 (H2 SO4 )?
解決策 :
各硫酸分子には、2 つの水素原子、1 つの硫黄原子、および 4 つの酸素原子が含まれています。したがって、分子量は次のとおりです。
H2 の分子量 SO4 =(2 x 水素の質量) + (1 x 硫黄の質量) + (4 x 酸素の質量)
周期表から、
H の質量 =1.008 amu
S の質量 =32.066 amu
Oの質量 =15.999 amu
これらの値を数式に組み込みます。
H2 の分子量 SO4 =(2 x 1.008 amu) + (1 x 32.066 amu) + (4 x 15.999 amu)
H2 の分子量 SO4 =2.016 amu + 32.066 amu + 63.996 amu
H2 の分子量 SO4 =98.078 amu
答え:
硫酸の分子量は 98.078 amu または 98.078 グラム/モルに相当します。
分子量とモル質量の違い
化合物のモル質量は、サンプルの質量をモル数で割ったものです。したがって、分子量はダルトンまたは amu で報告されますが、モル質量はモルあたりのキログラム (kg/mol) またはモルあたりのグラム数 (g/mol) です。技術的には、通常の分子量計算は実際にはモル質量計算です。これは、計算が周期表の平均原子質量を使用するためです。これは、天然元素の同位体存在量に基づく加重質量平均です。
ほとんどの場合、分子量とモル質量は交換可能です。ただし、2 つの例外があります。
<オール>参考文献
- 国際度量衡局 (2006 年)。 国際単位系 (SI) (第8版)。 ISBN 92-822-2213-6.
- International Union of Pure and Applied Chemistry (1993)。 物理化学における量、単位、記号 (第 2 版)。オックスフォード:ブラックウェル科学。 ISBN 0-632-03583-8.
- ポッソロ、アントニオ。 van der Veen, Adriaan M.H.;メイジャ、ジュリス。ヒバート、D. ブリン (2018)。 「標準原子量の不確かさの解釈と伝播 (IUPAC テクニカル レポート)」。 純粋化学と応用化学 . 90 (2):395–424. doi:10.1515/pac-2016-0402
- Wieser, M. E. (2006). 「元素の原子量 2005」 純粋化学と応用化学 . 78 (11):2051–66. doi:10.1351/pac200678112051