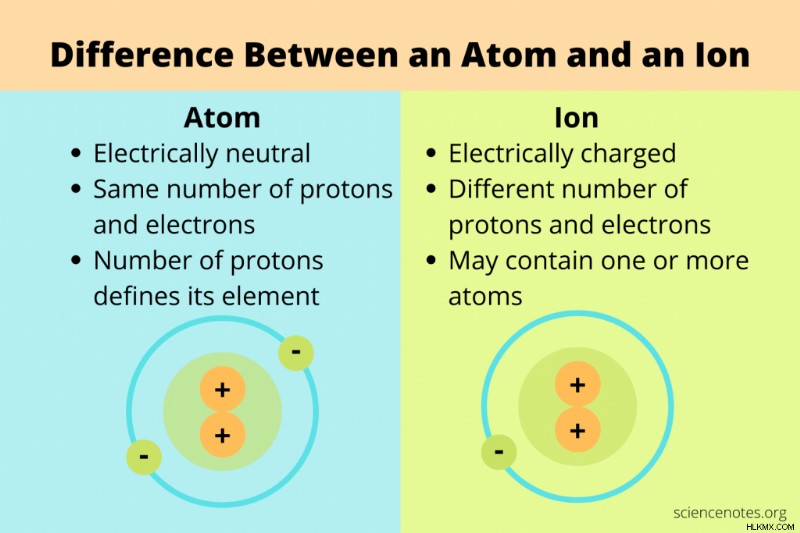
化学における原子とイオンの主な違いは、原子は中性粒子であるのに対し、イオンは正または負の電荷を持っていることです。
原子
原子 陽子、中性子、電子からなる物質の基本的な構成要素です。元素の同一性は、原子核内の正に帯電した陽子の数によって決定されます。
通常、化学者が原子について話すとき、それらは同じ数の陽子と電子を含む中性粒子を意味します。ただし、原子のより広い定義には、中性子 (同位体) と電子 (イオン) の数のすべての可能なバリエーションが含まれます。このより広い定義では、原子はイオンになることができますが、すべてのイオンが原子であるとは限りません。原子とイオンの違いは、正味の電荷に関係しています。
原子の例には、水素 (H)、ヘリウム (He)、鉄 (Fe)、および周期表のその他の元素が含まれます。
イオン
イオン 正味の正電荷または負電荷を持つ原子または原子の集まりです。
電子が追加または削除されると、中性原子はイオンになります。電子が除去されると、イオンの正味の電荷は正になり、陽イオンとして知られています。電子が追加されると、イオンの正味の電荷は負になり、陰イオンとして知られています。
イオンは原子の集まりでもあります。原子が結合すると多原子イオンが形成されますが、原子間の化学結合では電荷のバランスが取れません。
イオンの例をいくつか示します:
- フッ化物イオン :F – この陰イオンには 9 個の陽子と 10 個の電子があります。
- ナトリウムイオン :Na – この陽イオンには 11 個の陽子と 10 個の電子があります。
- 銅イオン :Cu と Cu – これらの陽イオンには、それぞれ 29 個の陽子と 28 個と 27 個の電子があります。
- アンモニウムイオン :NH4 – このイオンには、+1 の正味電荷を持つ 1 つの窒素原子と 4 つの水素原子が含まれています。
- 硫酸イオン :SO4 このイオンには、1 つの硫黄原子と 4 つの酸素原子が含まれており、正味の電荷は -2 です。
- 亜硝酸イオン :NO2 このイオンには、1 つの窒素原子と 2 つの酸素が含まれており、正味の電荷は -1 です。
その他の多原子イオンについては、この便利な表をご覧ください。