主な違い - 電解質と非電解質
化学化合物は、水溶液を通して電気を伝導する能力に応じて 2 つのカテゴリに分けることができます。これらの 2 つのカテゴリは、電解質と非電解質です。電解質は、水に溶けてイオンを形成する化合物です。これらのイオンは、溶液を通して電気を伝導することができます。非電解質は、水に溶けると電気を通さない化合物です。これは、水に溶けてもイオンを形成しないためです。電解質と非電解質の主な違いは、電解質は水に溶解するとイオン化できるのに対し、非電解質は水に溶解してもイオン化できないことです。
対象となる主な分野
1.電解質とは
– 電解特性の定義、説明と例
2.非電解質とは
– 例を含む一般的なプロパティの定義、説明
3.電解質と非電解質の違いは何ですか
– 主な相違点の比較
重要な用語:陰イオン、陽イオン、共有結合化合物、電解質、イオン化合物、イオン化、非電解質

電解質とは
電解質は、水に溶けるとイオンに分解できる化合物です。これらのイオンは、この水溶液を通して電気を伝導することができます。そのイオンに分解するために、電解質はイオン化合物でなければなりません。イオン性化合物は陽イオンと陰イオンからできています。
水に溶解すると、これらのイオン性化合物は水性陽イオンと陰イオンを形成します。これらのイオンは、溶液全体に均一に分散しています。その後、溶液は電気的に中性です。この溶液に外部から電流を流すと、溶液中のイオンが動き始めます。陽イオンは電子密度の高い電極に移動します。陰イオンは他の電極に移動する傾向があります。このイオンの動きにより、溶液に電流が流れます。
電解質には、強電解質と弱電解質の 2 種類があります。強力な電解質は完全にイオン化してイオンになります。強電解質の水溶液には中性分子はありません。弱い電解質は、そのイオンに完全に電離しません。したがって、溶液中には中性分子もいくつか存在します。
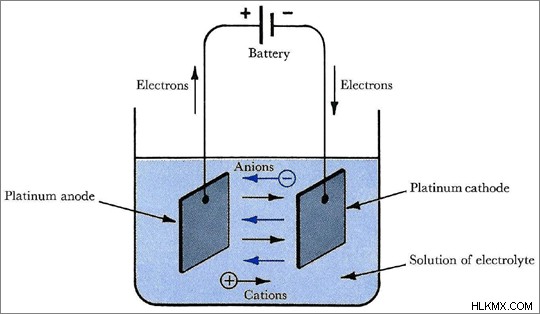
図 1:電解質は電気化学技術で使用されます
強酸と強塩基は、水中で完全にイオン化できるため、強電解質です。強電解質と見なされるためには、化合物が必ずしも水に完全に溶解する必要はありません。一部の化合物は水に部分的に溶解しますが、強力な電解質です。たとえば、水酸化ストロンチウム、Sr(OH)2 部分的に水に溶けています。しかし、溶解量が完全にイオン化されているため、強力な電解質です。また、NaCl、MgCl
弱酸と弱塩基は弱電解質と見なされます。これは、これらの化合物が部分的にイオンに解離するためです。ほとんどの窒素含有化合物は弱電解質です。水も弱電解質と見なされます。水分子は、ヒドロキシル イオンとヒドロニウム イオンと平衡状態にあります。
非電解質とは
非電解質は、水溶液が溶液を通して電気を伝導できない化合物です。これらの化合物はイオンの形では存在しません。ほとんどの非電解質は共有結合化合物です。水に溶解すると、これらの化合物はまったくイオンを形成しません。

図 2:砂糖は水に完全に溶けますが、電解質ではありません。
炭化水素などのほとんどの炭素化合物は、水に溶けないため、非電解質です。グルコースなどの一部の化合物は水に溶けますが、イオン化はしません。グルコースの水溶液は、グルコース分子で構成されています。したがって、糖、脂肪、およびアルコールは非電解質です。通常、非電解質は非極性化合物です。
電解質と非電解質の違い
定義
電解質: 電解質は、水に溶解するとイオンに分解できる化合物です。
非電解質: 非電解質は、水溶液が溶液を通して電気を伝導できない化合物です。
導電率
電解質: 電解質は、水溶液を通して電気を伝導できます。
非電解質: 非電解質は、水溶液を通して電気を通すことができません。
化学結合
電解質: 電解質はイオン結合で構成されています。
非電解質: 非電解質は共有結合で構成されています。
化合物
電解質: 電解質はイオン化合物です。酸、塩基、塩は電解質です。
非電解質: 非電解質は共有結合化合物です。炭素含有化合物、脂肪、砂糖は非電解質です。
タイプ
電解質: 電解質には強電解質と弱電解質があります。
非電解質: 非電解質は、水溶性化合物と水不溶性化合物として見つけることができません.
結論
電解質と非電解質は、水溶液を通して電気を伝導する能力または電気伝導能力がないことに基づいて名前が付けられた化合物です。この能力は、化合物のイオン化に依存します。言い換えれば、イオンを通して電気を伝導するためには、化合物をイオンに分解する必要があります。電解質と非電解質の主な違いは、電解質は水に溶解するとイオン化できるのに対し、非電解質は水に溶解するとイオン化できないことです。
画像提供:
1. 「Chemical Principles Fig 1.9」 By .元のアップロード者は Elo 1219 at English Wikibooks – en.wikibooks から Commons に転送されました。 (CC BY 3.0) コモンズ ウィキメディア経由
2. APN MJMによる「ガラス付きスプーンシュガーソリューション」–コモンズウィキメディア経由の自作(CC BY-SA 3.0)







