リチウムは、元素記号 Li の周期表の原子番号 3 です。特性、用途、および供給源を含む、リチウムに関する事実のコレクションです。

リチウムの基本情報
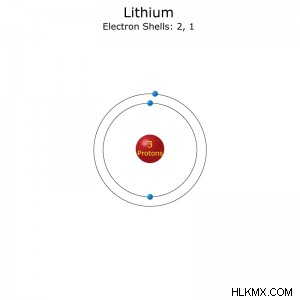
名前: リチウム
原子番号: 3
元素記号: リー
グループ: 1
期間: 2
ブロック:
エレメント ファミリー: アルカリ金属
原子質量: [6.938; 6.997] IUPAC ガイドライン
6.941 は通常、単一の値に使用されます
電子配置: [He]2s (略記) または 1s2s (フル)
発見: ヨハン・アウグスト・アルフウェドソン、1817年。
Arfwedson はペタライト鉱石を分析していました。燃やすと真っ赤な炎を出しました。さらなる調査により、アルカリ金属のように作用するがナトリウムよりも軽い物質が含まれていることがわかりました。彼は、電気分解を使用して金属を分離することにより、金属の純粋なサンプルを提供しようとしましたが、成功しませんでした。 1821 年、英国の化学者ウィリアム ブランデは、純粋なリチウムの非常に少量のサンプルを作成しましたが、有用な測定を行うには十分ではありませんでした。リチウムは、1855 年にドイツの化学者ロバート ブンセンと英国の化学者アウグストゥス マシーセンによって大量生産されることはありませんでした。
名前の由来: リトス (ギリシャ語で「石」を意味する) Arfwedson は、その起源を反映する石にちなんでアルカリ金属に名前を付けました。ナトリウムやカリウムなどの他のアルカリ金属は、植物によく見られます。
一般的な同位体:
リチウムは主に 2 つの安定同位体で構成されています。リチウム 3 からリチウム 12 までの範囲の同位体が実験室で生成されています。
リー
リチウム 6 は、3 つの中性子を含むリチウムの安定同位体です。天然リチウムの 7.59% にはリチウム 6 が含まれています。
リー
リチウム-7 は最も一般的な同位体です。 4 個の中性子を含み、すべての天然リチウムの 92.41% を占めます。
物理データ

密度: 0.534g/cm
融点: 453.65 K (180.50 ºC または 356.90 ºF)
沸点: 1615 K (1342 ºC または 2448 ºF)
重要なポイント: 67 MPa で 3220 K (外挿)
20ºC での状態: 固体
融合の熱: 3.00kJ/モル
気化熱: 136kJ/モル
モル熱容量: 24.860 J/mol・K
原子データ
原子半径: 1.52 Å (経験値)
共有半径: 1.30Å
ファン デル ワールス半径: 1.82Å
電子親和力: 59.633 kJ/mol
電気陰性度: (ポーリングスケール):0.98
1 イオン化エネルギー: 520.222 kJ/mol
2 イオン化エネルギー: 7298.15 kJ/mol
3 イオン化エネルギー: 11815.044 kJ/mol
一般的な酸化状態: +1
楽しいリチウムの事実

- リチウム は最も軽い金属です。
- リチウムは、あらゆる金属の中で最も密度が低いです。リチウムは水に浮くことができます。
- リチウムは光沢のある柔らかい金属で、水と激しく反応して強力な腐食性の塩基を形成します。このため、リチウムは石油に保存されることがよくあります。
- リチウムは真っ赤に燃えます。赤い火花を作るためにリチウムが花火に追加されます。
- リチウムは充電式電池に広く使用されています。また、多くの陶器にも使用されています。
- リチウムは、軽量化と強度向上のために、アルミニウムとマグネシウムへの合金添加剤として使用されます。
- リチウムは元素の形では見つかりません。リチウムは、リチウムを含む鉱石を電気分解することによって生成されます。リチウム含有鉱石の最大の鉱床はチリにあります。
- 最初の人工核反応は、リチウムからトリチウムへの変換でした。
- 炭酸リチウムは、躁うつ病や双極性障害の治療に少量使用されます。
- 重水素化リチウムは、熱核爆弾の燃料として早期に検討されました。リチウムはトリチウムを生成し、重水素と融合してエネルギーを放出します。
- 他のアルカリ金属と同様に、リチウムは石鹸の製造に使用できます。リチウム石鹸は、多くの市販の潤滑剤に使用されています。
周期表の元素の詳細をご覧ください。







