酸素は周期表の8番目の元素です。原子番号 8 で、元素記号は O です。酸素は、呼吸に必要な元素として最もよく知られていますが、他にも多くの興味深い特性を持っています。これらの酸素の事実には、一般的な情報と歴史とともに、化学的および物理的データが含まれています。

基本的な酸素の事実
名前: 酸素
原子番号: 8
元素記号: O
グループ: 16
期間: 2
ブロック: p
エレメント ファミリー: 非金属
原子質量: [15.999 03; 15.999 77] IUPAC ガイドライン。単一の値の場合は、15.9994 を使用してください。
電子配置: [He]2s2p(短縮形) または 1s2s2p(フル)
発見: 1773 年にカール ヴィルヘルム シェーレ、1774 年にジョセフ プリーストリー。両方の男性は、特定の酸化物を加熱するとガスが放出され、ろうそくがより明るく燃えることに気づきました。プリーストリーはさらに一歩進んで、マウスを酸素の瓶に入れました。彼はそれが窒息するまでほんの数分しか生き残れないと思っていました。代わりに、マウスは瓶の中で 1 時間後も生きていました。
名前の由来: フランスの化学者アントワーヌ・ラヴォアジエは、元素をギリシャ語の oxys から酸素と名付けました。 「酸」と遺伝子を意味します 「形成する」という意味。当時、すべての酸は反応の一部に酸素を必要とすると考えられていました.
同位体:
天然酸素は、O、O、および O の 2 つの安定同位体で構成されています。放射性同位体は、O から O までの範囲の実験室条件下で生成されています。
〇
酸素 16 は、8 個の中性子を含む安定同位体です。自然酸素の 99.757% は酸素 16 です。
〇
酸素 17 は、9 個の中性子を含む安定同位体です。自然酸素の 0.038% は酸素-17 です。
〇
酸素 18 は、9 個の中性子を含む安定同位体です。自然酸素の 0.205% は酸素-18 です。

物理データ
密度: 0.001308g/cm
融点: 54.36 K (−218.79 °C, −361.82 °F)
沸点: 90.188 K (−182.962 °C、 −297.332 °F)
トリプルポイント: 0.1463 kPa で 54.361 K
重要なポイント: 5.043 MPa で 154.581 K
20ºC での状態: ガス
融合の熱: O2 に対して 0.444 kJ/mol
気化熱: O2 では 6.82 kJ/mol
モル熱容量: O2 に対して 29.378 J/mol·K
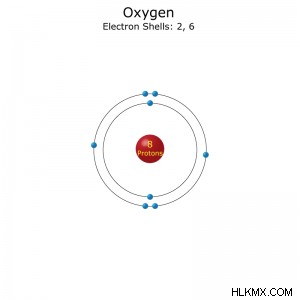
原子データ
原子半径: 1.52Å
共有半径: 0.64Å
ファン デル ワールス半径: 1.55Å
電子親和力: 140.976 kJ/mol
電気陰性度: (ポーリングスケール):3.44
1 イオン化エネルギー: 1313.942 kJ/mol
2 イオン化エネルギー: 3388.671 kJ/mol
3 イオン化エネルギー: 5300.47 kJ/mol
4 イオン化エネルギー: 7469.271 kJ/mol
5 イオン化エネルギー: 10989.584 kJ/mol
6 イオン化エネルギー: 13326.526 kJ/mol
7 イオン化エネルギー: 71330.65 kJ/mol
8 イオン化エネルギー: 84078.3 kJ/mol
酸化状態: -2、-1 (普通)、+2、+1 (珍しい)

楽しい酸素の豆知識
- 酸素は無色無味無臭の気体ですが、液体酸素は独特の青色をしています。
- 酸素は、呼吸する空気の体積の約 21% を占めています。
- 地球の地殻のほぼ半分は酸素です。
- 酸素は人体に最も多く存在する元素で、体重の 65% を占めています。
- すべての動植物は生きるために酸素を必要とします
- 酸素は燃えません。ただし、他の物質の燃焼をサポートするため、可燃性の物質の近くに保管しないでください。
- 酸素は水に溶けやすい。この特性により、水中での生活が可能になります。
- 酸素ガスは、鉄鋼業で鉄鋼を製造するために広く使用されています。また、過酸化水素や硝酸の製造にも使用されます。化合物エポキシエタンは、一般的なポリマーであるポリエステルと PVC (ポリ塩化ビニル) を作るために生成されます
- オーロラの緑色の波は、上層大気の酸素のイオン化によって引き起こされます。
- 自然界で酸素が単独で見つかることはめったにありません。酸素はそれ自体に結合して、二原子 O2 を形成します .オゾンは、式 O3 を持つもう 1 つの純粋な酸素分子です。 .
- オゾンは、上層大気で太陽からの有害な紫外線を吸収するために不可欠です。ただし、地面に近いオゾンは汚染物質と見なされ、生命に危険です。
- 1961 年まで、酸素は他の元素の原子量を測定するための標準でした。それは、炭素 12 の質量に置き換えられました。
周期表の元素の詳細をご覧ください。