「自由エネルギー」とは、有用な仕事をするために利用できる、または自由に使える最大のエネルギーを意味します。ギブスの自由エネルギーは、この方法を提案した物理学者のジョサイア ウィラード ギブスにちなんで名付けられました。"
部屋を掃除した後、数日以内に再び散らかっていることに気付くことがよくあります。部屋を常に片付ける必要があるのはなぜですか?
今度あなたのお母さんがこれについてあなたに講義するとき、エントロピーとギブスの自由エネルギーについて彼女に話すことができるかもしれません!
雑然としたオブジェクトのエントロピーは、順序付けられたオブジェクトのエントロピーよりも大きくなります。プロセスや反応の自発性は、常により高いエントロピーに向かっています。これは、あなたの部屋が急速に混乱する傾向があることを意味します!
とはいえ、ごちゃごちゃしたことの新しい言い訳ができました。

エントロピーは、システム内の無秩序またはランダム性の尺度です。
自由エネルギー
アメリカの数学者で物理学者のジョサイア・ウィリアード・ギブスは、自由エネルギーの概念を開発しました。彼が提案した自由エネルギーの方法は、ギブスの自由エネルギーとして広く知られています。 1873 年に、彼の出版物「流体の熱力学におけるグラフィカルな方法」は、さまざまなシステムを理解するためのより単純な表現形式を導入しました。
当時、彼はこの自由エネルギーをエネルギー/利用可能エネルギー (ε) と呼んでいましたが、最終的にギブスの自由エネルギーとして人気を博しました.

Josiah Willard Gibbs の米国で印刷された郵便切手 (写真提供:catwalker/Shutterstock)
熱力学のパラメータ
熱力学では、物質自体の組成や原子・分子構造の詳細に立ち入ることなく、系の振る舞いを理解することができます。体積、圧力、温度、エンタルピー、エントロピー、完了した仕事量、ギブスの自由エネルギーなどのパラメーター/関数を使用してシステムを理解します。したがって、熱力学は、物理的および化学的プロセスの観点から、特定のシステムの特性をその動作に関連付けます。
また、システムの平衡状態にも関係しています。平衡状態では、温度、密度、化学組成などのシステムの巨視的特性は明確に定義され、時不変です。熱力学は、ある状態から別の状態への系の遷移のみに関心があり、系がその最終状態に到達するまでの経路には関心がありません。さらに、圧力、体積、温度などのパラメーターは、システムの動作を理解するのに役立ちます。これらのパラメーターはパスに依存せず、状態関数と呼ばれます。

モールの 3 階にあるフード コートに行くには、エスカレーターまたはエレベーターのいずれかを使用できます。どちらの道も私たちをフードコートに連れて行きます。この例は「パスに依存しない」ため、これは状態関数のアナロジーです。
熱力学の応用
熱力学の適用により、特定のシステムまたは化学反応を達成することが不可能であることが示されている場合、それは実験室では決して達成できないか、実験室でまだ達成されていません まだ .熱力学の応用の注目すべき例は、グラファイトをダイヤモンドに変換することです。熱力学は、温度と圧力の特定の極端な条件下でこのような変換の可能性を示しました。しかし、科学者は長い一連の失敗の後にのみこの偉業を達成しました。このように、熱力学は、科学者が決してあきらめないことを保証することができます!
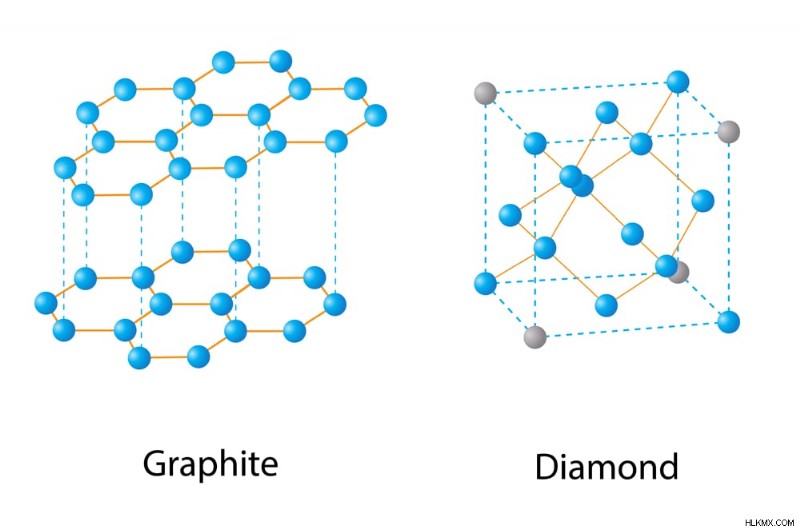
グラファイトとダイヤモンドはどちらも炭素原子でできていますが、それらの構造はまったく異なります。それがさまざまなエントロピーの理由です. (写真提供:Nasky/Shutterstock)
研究中のシステムについて熱力学を通じて推測しようとするとき、仕事と熱の式を取得することが重要です。
仕事と熱
仕事は、システムとその周囲の間の機械的リンクによって伝達されるエネルギーとして説明されます。これはパス依存であり、状態関数ではありません。仮説的なシステムを研究することは有用ですが、現実の世界では、システムと周囲の間でエネルギーが伝達されるさらに別の方法があります。このエネルギー伝達は、熱と呼ばれる、システムと周囲との間の温度差によるものです。熱は高温の媒体から低温の媒体に移動します。

あらゆるプロセスの自発性の例。熱は高温の媒体から低温の媒体に移動するため、氷の融解は室温での氷の形成よりも自然に起こります。
熱力学には 3 つの法則があります。最初の法則はエネルギー保存の原則です。「エネルギーは生成も破壊もされませんが、ある形から別の形に変換できます。」
宇宙のエネルギーは常に一定です
第一法則の数学的表現
吸収される熱 =内部エネルギーの増加 + システムによって行われる仕事
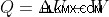
システムによって行われる仕事は負であり、「–W」で表されますが、システムで行われる仕事は正であり、「+W」で表されます。
内部エネルギーは、システム内のすべての粒子の運動エネルギーと位置エネルギーの合計です。
一定の圧力条件でシステムを扱っている場合、システムの内部エネルギーの代わりにシステムのエンタルピーを使用する慣行があります。
エンタルピーと内部エネルギーの数学的関係
システムに蓄えられる総エネルギー (エンタルピー) =内部エネルギー + 圧力と体積の積
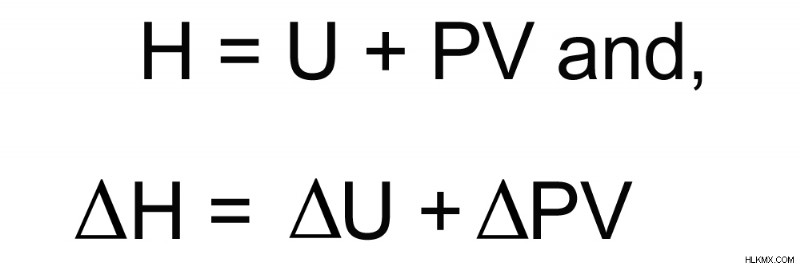
圧力 (P) が一定の場合
これは熱力学の第 2 法則であり、第 1 法則の制限であった特定のシステムの自発性または実現可能性の概念を考慮に入れています。この法則はエントロピーの概念を導入し、システムのすべての非平衡状態が最終的に自然な方法で平衡状態に移行することを示しています。
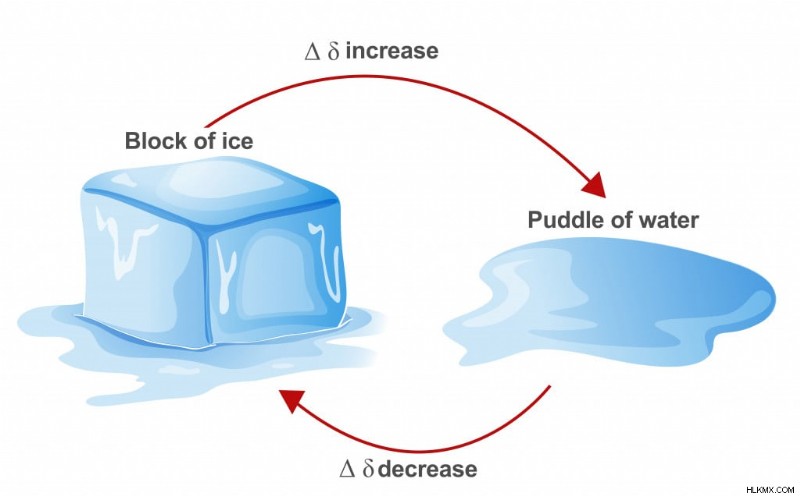
氷の融解と形成の過程における熱力学第 2 法則の図。
エントロピー
エントロピー (S) は状態関数であり、システムと環境の両方のエントロピーの変化は、システムまたは反応に関する重要な結論をもたらします。


宇宙には正のエントロピーがあります。これは、宇宙のエントロピーが増加していることを意味します:秩序から無秩序へ
不可逆的または自発的なプロセスでは: 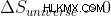 つまり、エントロピーは正です。
つまり、エントロピーは正です。
一方、可逆プロセスでは、 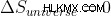 .そしていつ、
.そしていつ、 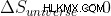 私たちは、そのような宇宙やシステムは自然発生的ではないと考えています.
私たちは、そのような宇宙やシステムは自然発生的ではないと考えています.
第 3 法則は、第 0 法則とも呼ばれます。システムが絶対零度 (0 K) に近づくと、システムのエントロピーはゼロになると述べています。
ギブスの自由エネルギー
熱力学の第二法則から、システム/プロセスの自発性と実現可能性を推測して理解することができます。ただし、周囲のエントロピーを取得することが難しくなります。したがって、プロセスの自発性の唯一の基準としてエントロピーを考慮することはあまり便利ではありません。 1873 年に Gibbs によって発表された論文は、別のより単純な基準を概説しました。これは、自由エネルギー (G) と呼ばれる別の熱力学的関数を導入することによって行われました。システムの自由エネルギーの変化は、プロセスの自発性を決定する基準となり、周囲の自由エネルギーを考慮する必要はありません.
いつ  の場合、システムは自発的または製品に有利なプロセスであり、不可逆的なプロセスでもあります。一方、
の場合、システムは自発的または製品に有利なプロセスであり、不可逆的なプロセスでもあります。一方、  の場合、システムは平衡状態にあり、可逆プロセスです。場合には
の場合、システムは平衡状態にあり、可逆プロセスです。場合には  の場合、そのようなシステムは非自発的なプロセスです。
の場合、そのようなシステムは非自発的なプロセスです。
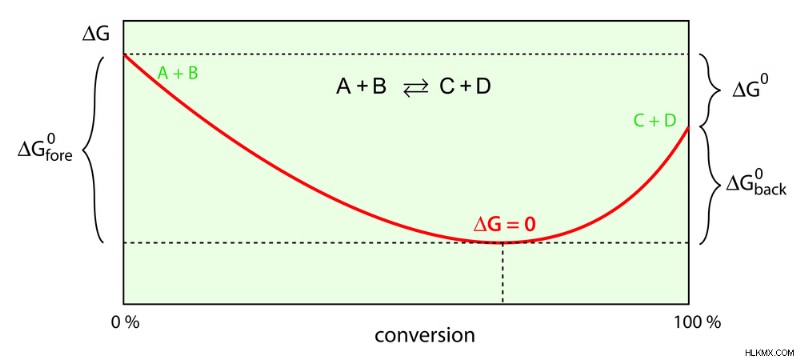
曲線は、さまざまな化学反応に対するギブズ自由エネルギーの変化を示しています (写真提供:magnetix/Shutterstock)
ギブスの自由エネルギーと仕事の関係
理論的には、自発的な反応は有用な仕事を生み出します。それらのエネルギーは、反応の発生を直接助けます。最大の有用な作業が得られると、そのような反応はエントロピーを生成しません.
したがって: 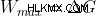
ただし、実際には、この有用な作業は常に最大作業よりも少ないため、いくらかのエントロピーが作成されます。
システムが平衡状態に達すると、外部仕事を実行する能力が失われます。システムの自由エネルギーは、初期状態のエネルギーと平衡状態のエネルギーの差であるため、仕事をするために利用できるエネルギーです。平衡状態のエネルギーは「利用できないエネルギー」と呼ばれ、温度とエントロピーの積として数学的に表されます。
ギブズ自由エネルギーの数式
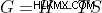 、一定の温度と圧力で。
、一定の温度と圧力で。
そして、反応が進むにつれて:
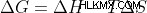
システムが最大エントロピーの状態を取得すると ( 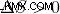 ) および最小ギブズ自由エネルギー (
) および最小ギブズ自由エネルギー (  )、システムは平衡状態に達しています。したがって、熱とエントロピーの変化は、ギブズの自由エネルギーに影響を与える 2 つの要因であり、物理的または化学的変化の自発性に影響を与えると言えます。
)、システムは平衡状態に達しています。したがって、熱とエントロピーの変化は、ギブズの自由エネルギーに影響を与える 2 つの要因であり、物理的または化学的変化の自発性に影響を与えると言えます。
ギブズ自由エネルギーに基づく化学反応のカテゴリ
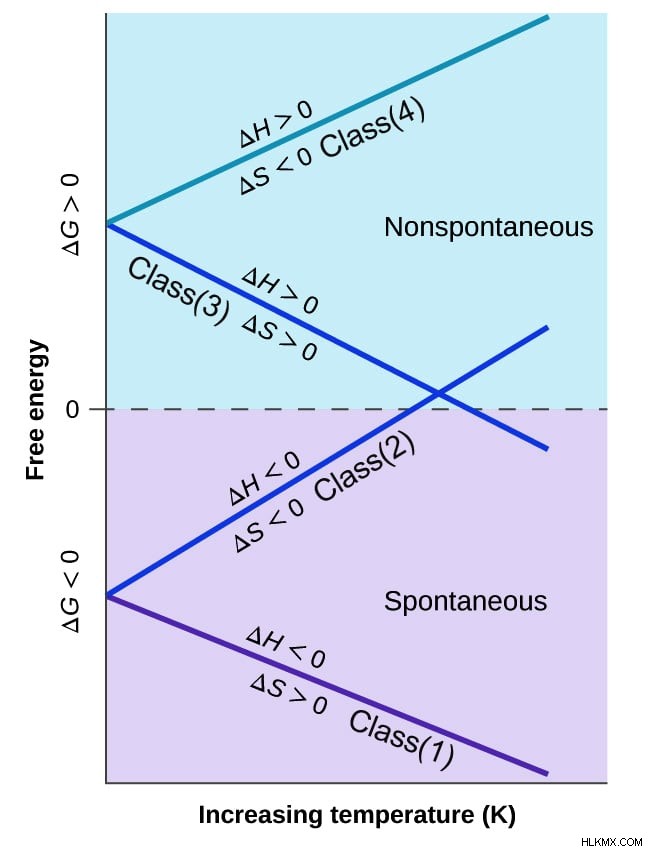
異なる温度でのギブズフリーエネルギー値に基づく反応の 4 つのクラス
ギブズ自由エネルギーの変動を知ることで、プロセスの自発性を予測できます。異なるプロセスには異なるギブス自由エネルギーがあり、温度による変化に基づいて、それらを 4 つのクラスの反応に分類します。
クラス 1 の反応は、すべての温度で自発的または生成物に好都合です。クラス 2 および 3 のタイプの反応では、正反応の自発性は温度に依存します。クラス 2 では、反応は低温で生成物に有利になり、クラス 3 では、生成物に有利な反応が高温になります。クラス 4 タイプの反応は反応物に有利に働き、すべての温度で非自発的です。
したがって、ギブスの自由エネルギー方程式は、プロセスが平衡に達する温度を推定するのに役立ちます。







