理論収量 化学反応の量は、反応物が完全に反応した場合に得られる生成物の量です。理論上の収量を計算するための手順と、問題の例を次に示します。
理論収量の計算手順
<オール>これらのステップのいくつかは、理解しなくても知っている場合があります。たとえば、平衡方程式を知っているか、制限反応物が与えられている可能性があります。たとえば、一方の反応物が「過剰」である場合、もう一方 (反応物が 2 つしかない場合) が制限反応物であることがわかります。
理論収量の例題
塩素酸カリウム(KClO3 ) は酸素ガス (O2 ) および塩化カリウム (KCl)。
2 KClO3 (秒) → 3 O2 (g) + 2 KCl (秒)
この反応は、酸素ガスを得る比較的安価な方法であるため、学校の実験室ではかなり一般的です.
平衡反応は、2 モルの KClO3 3 モルの O2 を生成する と 2 モルの KCl。理論収量を計算するには、これらの比率を換算係数として使用します。これが典型的な問題の例です。
質問: 735.3 グラムの KClO3 を加熱すると生成される酸素ガスのモル数 ?
問題はバランスの取れた方程式を与え、制限反応物 (この場合、唯一の反応物) を特定するので、KClO3 のモル数を知る必要があります。 .これは、KClO3 グラムを換算して行います モル KClO3 .これを簡単にするために、KClO3 の分子量を知っておいてください は 122.55 g/mol です。
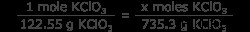
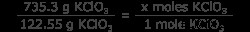
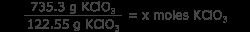
6 =x モル KClO3
化学式を使用してモル KClO3 を関連付けます モル O2 .これは、2 つの化合物のモル比です。 2モルのKClO3が見えます 3 モルの O2 を生成する ガス。モル比を使用して、6 モルの塩素酸カリウムによって形成される酸素のモル数を見つけます。
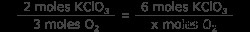
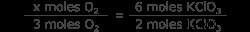

x mol O2 =3 x 3 モル O2
x mol O2 =9 mol O2
6モルのKClO3 (735.3 グラムの KClO3 ) 9 モルの O2 を生成する
技術的には、これは理論上の収量ですが、モルをグラムに変換すると答えがより便利になります.変換には、酸素の原子量と分子式を使用します。周期表から、酸素の原子量は 16.00 です。各O2には2つの酸素原子があります 分子。
x グラム O2 =(2)(16.00 グラム O2 /モル)
x グラム O2 =32 グラム/モル
最後に、理論上の収率は、酸素ガスのモル数にモルからグラムへの変換係数を掛けたものです。
O2 の理論収量 =(9 モル)(32 グラム/モル)
O2 の理論収量 =288 グラム
製品を作るために必要な反応物を計算
理論収量計算のバリエーションは、あらかじめ決められた量の生成物が必要な場合に使用する反応物の量を見つけるのに役立ちます。ここでも、平衡方程式から始めて、反応物と生成物のモル比を使用します。
質問: 90 グラムの水を生成するには、何グラムの水素ガスと酸素ガスが必要ですか?
ステップ 1:バランスのとれた方程式を書きます。
不均衡な方程式から始めます。水素ガスと酸素ガスが反応し、水が生成されます:
H2 (g) + O2 (g) → H2 O(l)
式のバランスをとると、モル比が得られます:
2 H2 (g) + O2 (g) → 2 H2 O(l)
ステップ 2:制限反応物を特定します。
この場合、反応を逆方向に処理しているため、生成物 (水) の量が限界です。
ステップ 3:制限反応物のグラムをモルに変換します。
モル H2 O =(90 グラム H2 O)(1 mol H2 O/18.00 グラム H2 O)
モル H2 O =5モル
ステップ 4:モル比を使用します。
平衡式から、H2 のモル数の間には 1:1 のモル関係があります。 と H2 O. つまり、5 モルの水は 5 モルの水素を反応させることで得られます。
ただし、O2 のモル比は 1:2 です。 と H2 O.水のモル数と比較して、酸素ガスのモル数の半分が必要です.
モル O2 =(モル比)(モル水)
モル O2 =(1 mol O2 /2 mol H2 O)(5 mol H2 O)
モル O2 =2.5モル
ステップ 5:モルをグラムに変換します。
グラム H2 =(モル H2 )(2 g H2 /1 mol H2 )
グラム H2 =(5 mol H2 )(2 g H2 /1 mol H2 )
グラム H2 =(5 mol H2 )(2 g H2 /1 mol H2 )
グラム H2 =10 グラム
グラム O2 =(モル O2 )(32 g O2 /1 mol O2 )
グラム O2 =(2.5 mol O2 )(32 g O2 /1 mol O2 )
グラム O2 =80 グラム
したがって、90 グラムの水を作るには、10 グラムの水素ガスと 80 グラムの酸素ガスが必要です。
参考文献
- Petrucci, R.H., Harwood, W.S.;ニシン、F.G. (2002) 一般化学 (第8版)。プレンティス・ホール。 ISBN 0130143294.
- フォーゲル、A.I.; Tatchell、AR。ファーニス、BS。ハナフォード、A.J.; Smith, P. W. G. (1996) Vogel's Textbook of Practical Organic Chemistry (第5版)。ピアソン。 ISBN 978-0582462366.
- Whitten, K.W., Gailey, K.D.; Davis, R.E. (1992) 一般化学 (第4版)。サンダース大学出版. ISBN 0030723736.