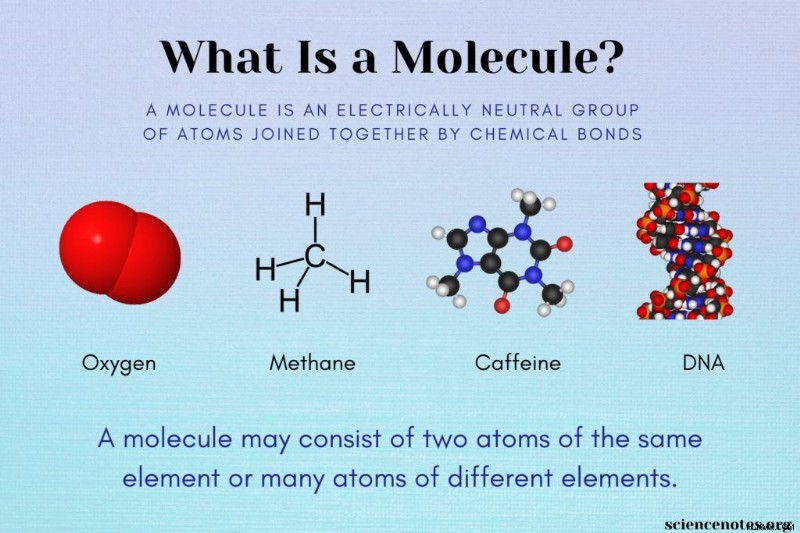
分子は、化学結合によって接続された 2 つ以上の原子の電気的に中性のグループとして定義されます。ここに分子の例と、分子、化合物、およびイオンの違いを示します。
原子 vs 分子
原子は元素の最小単位です。 1 つの元素のすべての原子には、同じ数の陽子が含まれています。原子は、化学的方法を使用してさらに分割することはできません。対照的に、分子は純粋な物質の単位です。分子は複数の原子で構成されています。与えられた分子は一定の組成を持っています。つまり、異なる原子の比率は常に同じです。同じ分子は、同じ化学的性質も示します。原子とは異なり、分子は化学反応によって壊れることがあります。分子内のすべての化学結合を切断すると、原子の集合になります。
分子の例
分子は、単一元素の 2 つ以上の原子または異なる元素の原子で構成されている場合があります。以下は分子の例です:
- H2 O(水)
- N2 (窒素)
- O3 (オゾン)
- CaO(酸化カルシウム)
- CO2 (二酸化炭素)
- C6 H12 O6 (ブドウ糖、砂糖の一種)
- NaCl(食卓塩)
- ヘモグロビン (C738 H1166 N812 O203_S2 Fe)
- ビタミン C またはアスコルビン酸 (C6 H8 O6 )
- デオキシリボ核酸 (DNA)
分子の種類
分子はその組成に従って分類されます:
- 二原子分子 – 二原子分子は、2 つの原子のみで構成されます。これらは、単一元素の原子 (同核) または異なる元素の原子 (異核) である可能性があります。 O2 等核二原子分子の例です。 HCl は異核二原子分子の一例です。
- 多原子分子 – 多原子分子は、2 つ以上の原子で構成されます。グルコース (C6 H12 O6 ) と水 (H2 O) は多原子分子の例です。
- 高分子 – 高分子は非常に大きな分子で、多くの場合サブユニットで構成されています。タンパク質と DNA は高分子の例です。
分子を分類するもう 1 つの方法は、化学結合によるものです。
- 共有分子 – 共有分子は、共有化学結合によって接続された原子で構成されます。共有分子は非金属で構成されています。純粋な共有結合分子では、原子は同じ電気陰性度の値を持ちます。純粋な共有結合分子の例は、H2 です。 そしてO3 .極性共有結合分子では、原子の電気陰性度の値がわずかに異なります。極性共有結合分子の例は水 (H2 O) と塩酸 (HCl)
- イオン分子 – イオン分子は、金属と非金属の両方で構成されています (いくつかの例外があります)。カチオン (分子の最初の部分) とアニオン (分子の 2 番目の部分) は、非常に異なる電気陰性度の値を持っています。イオン分子は極端な極性を示しますが、通常、誰かが極性分子について話すときは、極性共有分子を意味します.イオン分子の例には、塩 (NaCl)、酢酸アンモニウム (NH4 CH3 CO2 – 非金属のみからなるイオン性化合物)、および水酸化ナトリウム (NaOH)。
分子と化合物の違い
化合物は、2 つ以上の 異なる で構成されます 化学結合によって結合された要素。水 (H2 O) と塩酸 (HCl) は化合物です。水素ガス (H2 ) とオゾン (O3 ) は分子ですが、化合物ではありません。すべての化合物は分子ですが、すべての分子が化合物というわけではありません。
分子とイオンの違い
分子は電気的に中性です。陽子と電子の総数は同じです。イオンには、さまざまな数の陽子と電子が含まれています。陽子が多い場合、イオンは正電荷を帯びます。電子が多い場合、イオンは負の電荷を帯びます。イオンは、原子 (O) または分子 (H3) として開始できます。 O)。電荷には常に + または – の上付き文字が付いているため、分子と区別できます。
そうでないもの 分子?
分子ではない物質の例は、原子とイオンです:
- H (水素原子)
- Ag (銀原子)
- PO4 (リン酸イオン)
さらに、合金は厳密には分子や化合物でもありません。これは、合金が金属と非金属の混合物で構成されているためです。元素はいくつかの化学結合を形成する場合がありますが、一定のモル比で会合することはありません.
参考文献
- ブラウン、T.L.;ケネス・C・ケンプ;セオドア・L・ブラウン。ハロルド・ユージーン・ルメイ。ブルース・エドワード・バーステン (2003)。 化学 – 中心科学 (第9版)。ニュージャージー:プレンティス ホール。 ISBN 978-0-13-066997-1.
- チャン、レイモンド (1998)。 化学 (第6版)。ニューヨーク:マグロウヒル。 ISBN 978-0-07-115221-1.
- IUPAC (1997)。 "分子。" 化学用語集 (第2版)(「ゴールドブック」)。オックスフォード:Blackwell Scientific Publications。 ISBN 0-9678550-9-8。 doi:10.1351/goldbook
- Zumdahl、Steven S. (1997)。 化学 (第4版)。ボストン:ホートン・ミフリン。 ISBN 978-0-669-41794-4.







