いくつかの要因が反応速度に影響します。化学反応は、反応物粒子が互いにうまく衝突した場合にのみ発生します。粒子の衝突が成功する可能性を高めるものはすべて、反応速度を高めます。
これらの要因を使用して化学反応の速度を制御することは、多くの化学プロセスにとって重要です。たとえば、非常に発熱反応を遅くすると、爆発を防ぐことができます。グロースティックの反応速度を速めると、その光が明るくなります。以下は、反応率に影響を与える要因のリスト、それらが機能する理由の説明、および反応率を上げることの限界についての説明です。
反応率に影響する要因のまとめ
| 係数 | 反応率への影響 |
| 気温 | 温度を上げると反応速度が上がります (ある程度まで) |
| プレッシャー | ガスの圧力を上げると反応速度が上がります |
| 集中力 | 溶液中の反応物の量を増やすと、反応速度が上がります |
| 触媒 | 触媒があると反応速度が上がります |
| 粒度 | 粒子サイズを小さくするか表面積を大きくすると、反応速度が上がります |
| 物理的状態 | 同じ物質状態の反応物は、異なる相の反応物よりも容易に反応します。混合すると反応率が向上します。|
| ライト | 一部の反応は、光から活性化エネルギーを得て、化学反応の速度を高めます。 |
| 反応物の性質 | 反応の種類によっては、本質的に他の反応よりも速いものがあります。 |
要因の詳細
気温
温度は、多くの場合、反応速度に最大の影響を与える要因です。温度が上昇すると、粒子に運動エネルギーが与えられるため、粒子はより速く跳ね返り、結合する可能性が高くなります。さらに重要なことに、追加されたエネルギーは、反応の活性化エネルギー要件を満たす可能性が高くなります。対照的に、温度を下げると分子は遅くなり、反応しにくくなります。
多くの化学反応の速度は、温度が 10 °C 上昇するごとに 2 倍になります。 「ルール」はほとんどの反応に適用されますが、すべてではありません。たとえば、多くの生化学反応速度は、はるかに小さな温度上昇で 2 倍になります。また、反応が遅くなったり停止したりする温度の上限があります。
プレッシャー
圧力が増加すると、反応物粒子が互いに接近し、相互作用と反応速度が増加します。ご想像のとおり、圧力は液体や固体よりも気体に大きく影響します。
集中力
液体および気体の反応物質の濃度を上げると、粒子間の衝突回数が増えるため、反応速度が上がります。
触媒の使用
触媒または酵素は、化学反応の活性化エネルギーを低下させます。反応が起こりやすいので、速くなります。
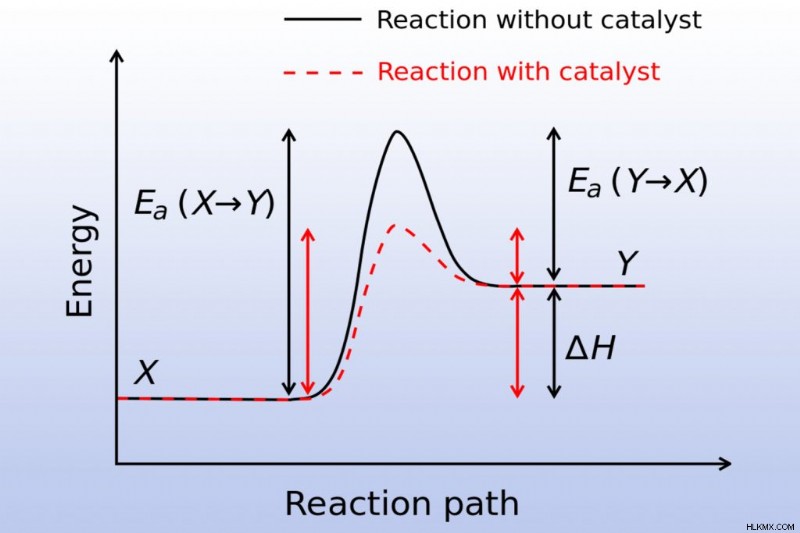
触媒は、反応物間の衝突の頻度を増やしたり、分子の配向を変更したり、反応物内の分子間結合を減らしたり、反応物に電子密度を与えたりします。触媒の存在によって化学反応が変化することはありませんが、より迅速に平衡に達するのに役立ちます。
対照的に、一部の物質は化学反応の速度を低下させます。これらの阻害剤は、反応物を求めて競合したり、反応物の向きを変えたり、化学結合形成の電子密度を変えたりする可能性があります。
粒子サイズ - 表面積
より小さな粒子サイズと増加した表面積により、反応物が衝突する機会が最大化されます。固体を粉末に粉砕すると、表面積が増加します。たとえば、金属マグネシウムの塊は空気中で酸化しますが、粉末マグネシウムは急速に酸化し、自然発火する可能性があります。
反応物の物理的状態
反応物 (固体、液体、気体) の物理的状態は、反応速度に影響します。同じ相の液体と気体の反応物は、熱運動によってそれらが一緒になるため、急速に反応する傾向があります。反応物が異なる相にある場合、反応速度は界面の表面積によって制限されます。ここでは、振とうと混合により、反応物が一緒になることで反応速度を速めることができます。
光の吸収
光は、一部の反応に必要な活性化エネルギーを提供します。これらの反応では、光の量を増やすと反応速度が上がります。光合成は、光の影響を受ける反応の良い例です。
反応物の性質
反応物の化学結合のタイプは、反応の発生速度に影響します。たとえば、酸塩基反応やイオン交換反応は反応が速い傾向にあります。大きな分子が関与する反応は遅くなる傾向があります。異なる化合物を選択して目的の生成物を生成することで、反応速度を上げることができる場合があります。たとえば、置換反応では、可溶性塩は溶解してより小さな粒子になるため、不溶性塩よりも可溶性塩を使用した方が反応が速くなります。
反応速度を速めるための制限
因子が化学反応の速度をどれだけ高めることができるかについては限界があります。たとえば、温度を上げると反応が速くなりますが、特定の温度を超えると反応物が変性する可能性があります。触媒を追加すると反応が速くなりますが、触媒を追加してもそれ以上速度が上がることはありません。
参考文献
- アトキンス P.; de Paula J. (2006)。 物理化学 (第 8 版) W.H.フリーマン。 ISBN 0-7167-8759-8.
- レイドラー、K. J. (1987). 化学反応速度 (第3版)。ハーパーとロウ。 ISBN 0-06-043862-2.
- スタインフェルド、J. I.;フランシスコ、JS。長谷, W. L. (1999). 化学反応速度論と動力学 (第 2 版)。プレンティスホール。 ISBN 0-13-737123-3.







