主な違い - 原子価と酸化状態
すべての化合物は、さまざまな元素の原子でできています。これらの原子は、それらが持つ利用可能な自由軌道の数または特定の原子が放出できる電子の数に応じて、さまざまな比率で結合されます。原子価と酸化状態は、これらの異なる原子の組み合わせの理由を説明するために使用される 2 つの用語です。原子価と酸化状態の主な違いは、原子価は特定の元素の原子の最外殻に存在する電子の数であるのに対し、酸化状態は特定の化合物の元素が失った、または獲得した電子の数であることです。 .
対象となる主な分野
1.ヴァレンシーとは
– 定義、指示、例
2.酸化状態とは
– 定義、適応症、酸化状態を決定するためのルール、例
3.原子価と酸化状態の違いは何ですか
– 主な違いの比較
重要な用語:原子、化合物、元素、シェル、酸化状態、原子価 
ヴァレンシーとは
原子価は、特定の元素の最外殻に存在する電子の数として定義できます。原子価は、特定の原子が持つことができる結合の最大数を決定します。周期表の元素は、原子が中性および気体状態にあるときに持つことができる価電子 (最も外側の軌道にある電子) の数に従ってグループ化されます。次の表でこれについて説明します。
要素 | 原子番号 | 電子配置 | 価数 |
| ナトリウム (Na) | 11 | 1s2s2p3s | 1 |
| マグネシウム (Mg) | 12 | 1s2s2p3s | 2 |
| ホウ素 (B) | 5 | 1秒2 2p | 3 |
| カーボン (C) | 6 | 1秒2 2p | 4 |
| 硫黄 (S) | 16 | 1s2s2p3s 3p | 6 |
元素は原子番号に従ってグループ化され、最外殻に存在する電子の数が同じであるため、周期表の同じグループの元素は同じ原子価を持ちます。
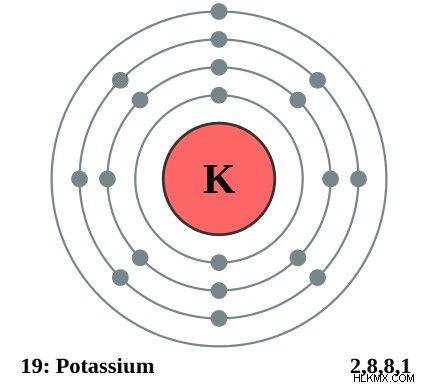
図 1:カリウムの価数は 1
酸化状態とは
酸化状態は、特定の原子が別の原子と失う、獲得する、または共有できる電子の数として定義できます。電子は負に帯電しており、それぞれの負電荷は原子核内の陽子の正電荷によって中和されるため、電子の損失または獲得によって原子の電荷が変化します。原子が電子を失ったり獲得したりすると、電荷の不均衡が生じます。したがって、その原子の酸化状態はその原子の電荷です。酸化状態は、化合物に含まれる原子の電荷を表すために使用できます。
酸化状態は、正 (+) または負 (-) 記号と数字を使用して表されます。記号はその原子の電荷を表し、数字は交換された電子の数を表します。
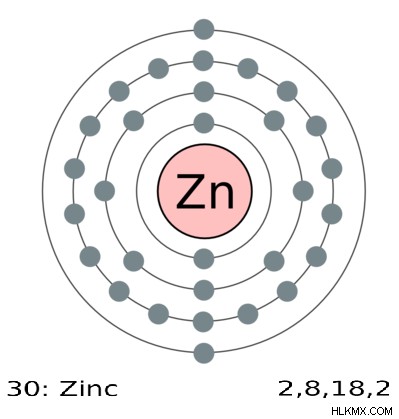
図 2:亜鉛の酸化状態は 0 と +2 のみ
酸化状態の判定方法
原子の酸化状態は、7 つの規則に基づいて計算されます。これらの規則と酸化状態の例を以下に示します。
ルール 1
元素の酸化状態は常にゼロです。元素形態の元素も酸化状態がゼロです。
例:ナトリウム (Na) の酸化状態は 0 で、水素 (H2) の酸化状態は ) は 0 です
ルール 2
分子またはイオンの総電荷は、化合物内の各原子の電荷の合計でなければなりません。
例:KCl 総電荷は 0
K の電荷 (酸化状態) は +1 です
Cl の電荷 (酸化状態) は -1
ルール 3
1 族元素の酸化状態は常に +1 です。
ルール 4
2 族元素の酸化状態は常に +2 です。
ルール 5
負電荷は、結合している他の原子と比較して、最も電気陰性度の高い原子に与えられます。
例:フッ素は最も電気陰性度の高い元素です。したがって、他の元素と結合している場合は常に、フッ素には-1 の酸化状態が与えられます。
ルール 6
水素 (H) の酸化状態は +1 です。
しかし、1 族金属の場合、水素の酸化状態は -1 です。
ルール 7
酸素 (O) の酸化状態は -2 です。
しかし、過酸化物では、O の酸化状態は -1 です。
| 複合 | エレメントX | X の酸化状態 |
| NH3 | X =N | -3 |
| KMnO4 | X =Mn | +7 |
| Cr2 O7 | X =Cr | +6 |
原子価と酸化状態の違い
定義
価数: 原子価は、特定の元素の最外殻に存在する電子の数として定義できます。
酸化: 酸化状態は、特定の原子が失う、獲得する、または別の原子と共有できる電子の数として定義できます。
充電
価数: 原子価は化合物中の原子の電荷を示すものではありません.
酸化: 酸化状態は、化合物中の原子の電荷を示します。
絆
価数: 原子価は、原子が持つことができる結合の最大数を決定します。
酸化: 酸化状態は、特定の原子が持つことができる結合の数を示すものではありません.
純粋な要素
価数: 純粋な元素の原子価は、原子 (気相の原子) の最外殻にある電子の数に依存します。
酸化: 純粋な元素の酸化状態は常にゼロです。
結論
原子価と酸化状態は、同じ値でも異なる値でもかまいません。原子価は特定の元素の最外殻に存在する電子の数ですが、酸化状態は特定の化合物の元素が失った、または獲得した電子の数です。これが原子価と酸化状態の主な違いです。