溶解度のルール in chemistry は、室温付近で水に溶ける無機化合物を特定するための一連のガイドラインです。
溶解度とは
溶解度 物質が溶媒に溶けて溶液を形成する度合いです。溶解する物質が溶質です。溶解する化学物質は溶媒と呼ばれます。
溶ける 化学物質は、任意の比率で溶媒に自由に溶解します。例えば、エタノールは水に溶けます。 不溶で 薬品は溶剤に溶けません。しかし、溶解度は全か無かのプロセスではありません。多くの化学物質はわずかに溶けます。つまり、完全には溶解しませんが、部分的にイオンに解離します。多くの「不溶性」化学物質は溶媒に非常に溶けにくいため、物質のごく一部が溶解します。
溶解性ルールとは?
溶解度ルールは、室温または室温付近の水中での無機化合物の溶解度を予測する一連のガイドラインです。可溶性化合物は水溶液を形成します。
| 可溶性化合物 | 例外 (解決できない) |
| アルカリ金属化合物 (Li、Na、K、Rb、Cs) | |
| アンモニウムイオン化合物 (NH4 ) | |
| 硝酸塩 (NO3 )、重炭酸塩 (HCO3 )、塩素酸塩 (ClO3 ) | |
| アセテート (C2 H3 O2 ) | |
| ハロゲン化物 (Cl、Br、I) | Ag、Hg、Pb のハロゲン化物 (可溶性の AgF を除く) |
| 硫酸塩 (SO4 ) | Ag、Ca、Sr、Ba、Hg、Pb の硫酸塩 |
| 不溶性化合物 | 例外 (解決可能) |
| 炭酸塩 (CO3 )、リン酸塩 (PO4 )、クロメート (CrO4 ) | アルカリ金属化合物 (Li、Na、K) およびアンモニウムイオン (NH4 ) |
| 水酸化物 (OH)、硫化物 (S) | アルカリ金属化合物およびCa、Sr、Baを含むもの |
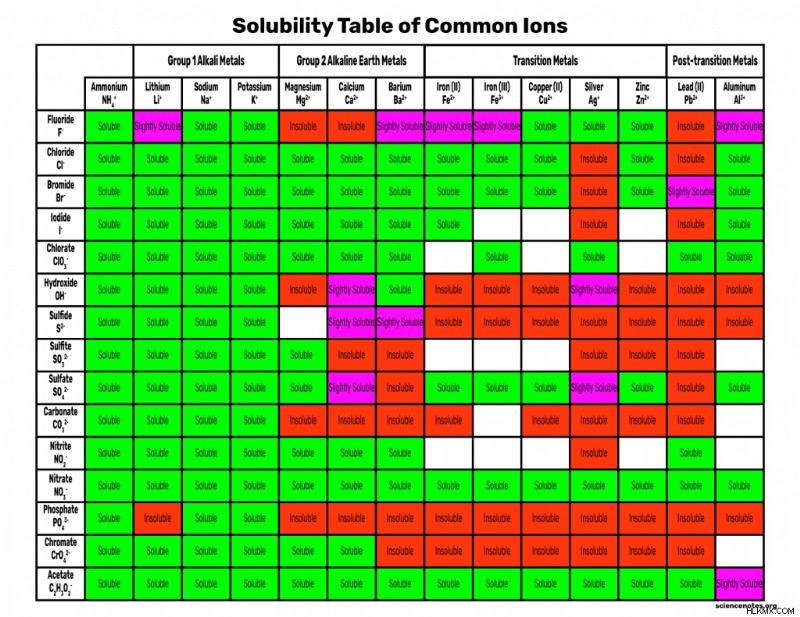
溶解度チャート
ダウンロードまたは印刷できる溶解度チャートを次に示します。画像を右クリックして保存するか、PDF ファイルをダウンロードしてください。
溶解度のルールを覚える方法
溶解度規則を覚える最も簡単な方法は、ニーモニック デバイスを使用することです。ほとんどの化合物をカバーする 4 つのニーモニックは、NAG、SAG、PMS、および Castro Bear です。 NAG と SAG は常に溶けますが、PMS とカストロ ベアは例外です。
NAG
- いいえ 繰り返す (NO3 )
- あ セテート (C2 H3 O2 )
- G グループ 1 (アルカリ金属:Li、Na、K など)
サグ
- S 硫酸塩 (SO4 )
- あ アンモニウム (NH4 )
- G グループ 17 (ハロゲン:F、Cl、Br など)
PMS
例外は、特定の金属化合物です。
- P :鉛、鉛
- M :水銀、Hg
- S :銀、銀
カストロ ベア
「カストロ ベア」と言うと、これらの金属と、類似の名前と記号を持つ他の金属との区別が容易になります。
- カルシウム (Ca)
- ストロンチウム (Sr)
- バリウム (Ba)
溶解度に影響する要因
いくつかの要因が溶解度に影響します:
- 気温 :溶解反応が吸熱反応の場合、溶解度は温度とともに上昇する傾向があります。溶解が発熱性である場合、溶解度は温度が上昇するにつれて減少する傾向があります。ほとんどの固体と液体の溶解は吸熱性であるため、通常、溶解度は温度とともに増加します。有機化合物の溶解度は、ほぼ常に温度とともに増加します (例外はシクロデキストリンです)。ガスの挙動はより複雑で、予測が困難です。
- フェーズ :溶解度は相に依存します。たとえば、アラゴナイトの溶解度は方解石とは異なりますが、どちらも炭酸カルシウム (CaCO3) の形態です。 ).
- 他の種の存在 :溶液中の他の種は、溶解度に影響を与えます。要因には、配位子、共通イオン、溶液のイオン強度が含まれます。
- プレッシャー :圧力は、固体と液体の溶解度に小さな役割を果たします。通常、ほとんどのアプリケーションでは無視されますが、油井の硫酸カルシウムによる汚れが発生する石油化学では重要です。圧力が低下すると、硫酸カルシウムの溶解度が低下します。
- 粒子の形状とサイズ :表面積が大きくなると溶解度が高くなる傾向があり、特に飽和に近づきます。そのため、細かい粉末は、単一のチャンクよりも溶けやすくなります。物質が結晶か非晶質かは問題です。通常、次数が増えると溶解度が低下します。
- 極性 :「似たような溶解」とは、極性溶媒が極性化合物を溶解し、非極性溶媒が非極性化合物を溶解することを意味します。
溶解性ルールの使用方法
溶解度ルールには、化学物質が溶解するかどうかの予測、沈殿物の形成の予測、サンプルの精製など、複数の用途があります。溶解度ルールを使用するには、陰イオン (イオンの負の部分) を調べて、それが可溶性か不溶性かを確認します。ルールの例外に注意してください。
たとえば、FeCO3
溶解度規則から、炭酸塩 (CO3 を含む化合物 ) 溶けにくい。だから、FeCO3 溶けない可能性が高いです。反応の生成物として、沈殿物を形成します。
たとえば、この反応から沈殿物が形成されるかどうかを予測します:
2AgNO3 + Na2 S → Ag2 S + 2NaNO3
Ag2 S または NaNO3 不溶性です。溶解度の規則から、硫化物は不溶性である傾向があるため、Ag2 S はおそらく沈殿物を形成します。 NaNO3 ほとんどの硝酸塩は可溶性であるため、可溶性であり、沈殿物を形成しません。 Ag2以降 S は沈殿物を形成しますが、この反応では沈殿物が形成されます。
溶解度規則は、すべての状況下での動作を予測するわけではありません。たとえば、それらは必ずしも有機化合物や極度の高温または低温で機能するとは限りません。このルールは、水中の単一化合物の純粋な溶液に最もよく適用されるため、実際の挙動は、混合物で予測される挙動から逸脱する可能性があります。それらは「ルール」と呼ばれていますが、実際には「ガイドライン」です。
参考文献
- ヘフター、G. T.; Tomkins, R. P. T (eds.) (2003)。 溶解度の実験的決定 .ワイリー・ブラックウェル。 ISBN 978-0-471-49708-0.
- IUPAC (1997)。 「溶解性」。 化学用語集 (「ゴールドブック」)(第2版)。ブラックウェル科学出版物。 doi:10.1351/goldbook.S05740
- Jain, N.; Yalkowsky、SH (2001)。 「水溶解度の推定I:有機非電解質への応用」。 Journal of Pharmaceutical Sciences . 90 (2):234–252。 doi:10.1002/1520-6017(200102)90:2<234::aid-jps14>3.0.co;2-v
- ペトルッチ、ラルフ H.;ら。 (2011)。 一般化学:原理と最新の応用 (第10版)。ニュージャージー州アッパー サドル リバー:ピアソン教育。 ISBN:978-0132064521.
- Ran, Y.; N.ジェイン; S. H. ヤルコウスキー (2001)。 「一般溶解度方程式(GSE)による有機化合物の水溶解度の予測」。 Journal of Chemical Information and Modeling . 41 (5):1208–1217. doi:10.1021/ci010287z