化学では、スペクテーター イオン 化学式で反応物と生成物の両方として発生するイオンですが、反応の平衡には影響しません。言い換えれば、彼らは他のイオンが水溶液中で反応するのを「観察」または「観察」します(溶媒が水の場合)。スペクテーター イオンは反応矢印の両側で発生するため、それらは「相殺」され、正味のイオン方程式には現れません。
スペクテイター イオンと正味のイオン方程式
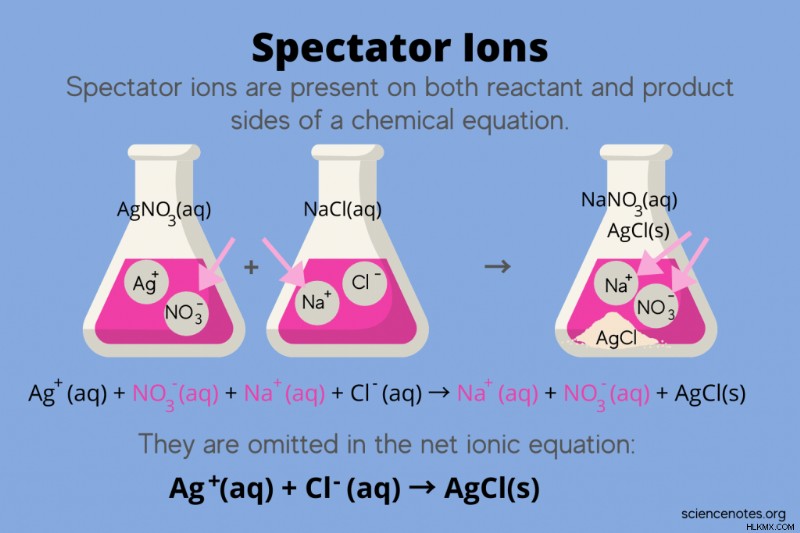
たとえば、硝酸銀 (AgNO3 ) と塩化ナトリウム (NaCl) は、硝酸ナトリウム水溶液 (NaNO
AgNO3 (aq) + NaCl(aq) → NaNO3 (aq) + AgCl(s)
全イオン方程式を書くと、スペクテーター イオンが明らかになります:
Ag(aq) + NO3 (aq) + Na(aq) + Cl(aq) → Na(aq) + NO3 (aq) + AgCl(s)
ナトリウム イオン (Na+) と硝酸イオン (NO3-) は反応の両側に現れるため、それらをキャンセルするか、または除去します。
Ag(aq) + NO3 (aq) + Na(aq) + Cl(aq) → Na(aq) + NO3 (aq) + AgCl(s)
これにより、正味のイオン方程式が残ります :
Ag(aq) + Cl(aq) → AgCl(s)
正味のイオン方程式は、反応に直接関与する化学種のみを示していることに注意してください。慣例により、陽イオン (この場合は Ag) を最初に書き、次に陰イオン (この場合は Cl) を書きます。正味のイオン方程式は、バランスの取れた化学方程式です。反応矢印の両側の原子の数と種類は同じです。反応矢印の両側の正味電荷は同じです。この場合、矢印の左側の「+」と「-」は互いに中和するため、矢印の両側の正味の電荷は 0 になります。
スペクテイター イオンの見つけ方
通常、生成物の 1 つが固体として沈殿する、水溶液中の二重置換 (二重置換) 反応を探します。このタイプの反応には、次の一般的な形式があります:
AB(aq) + CD(aq) → AD(aq) + CB(s) または AB(aq) + CD(aq) → AD(s) + CB(aq)
多くの場合、このタイプの反応は、中和反応として 2 つの塩間または酸と塩基の間で発生します。沈殿物が形成されるかどうかわからない場合は、溶解度チャートを参照するか、溶解度ルールを思い出してください。
一部の種は一般的にスペクテーター イオンとして発生します:
| 一般的なスペクテイター カチオン | 一般的な観客陰イオン |
|---|---|
| Li (リチウムイオン) | Cl (塩化物イオン) |
| Na (ナトリウムイオン) | Br (臭素イオン) |
| K (カリウムイオン) | I (ヨウ素イオン) |
| Rb (ルビジウムイオン) | NO3 (硝酸イオン) |
| Sr (ストロンチウムイオン) | ClO4 (過塩素酸イオン) |
| Ba (バリウムイオン) | SO4 (硫酸イオン) |
例外があります。たとえば、硫酸カルシウム (CaSO4 ) は不溶性であり、沈殿物を形成します。
観客イオンの例題
たとえば、スペクテーター イオンを特定し、塩化ナトリウム (NaCl) と硫酸銅 (CuSO4 ) 水中。
最初のステップは、反応の生成物を予測することです。溶解度の規則から、塩化ナトリウムと硫酸銅の両方が水中でイオンに解離することがわかります。したがって、反応におけるイオン交換パートナーを仮定すると (二重置換反応)、生成物は硫酸ナトリウムと塩化銅です。電荷のためのイオンのバランスをとる、それらの式は Na2 SO4 および CuCl2 .再び溶解度の規則から、硫酸ナトリウムは水性であることがわかりますが、塩化銅は沈殿物を形成します.
NaCl(aq) + CuSO4 (aq) → Na2 SO4 (aq) + CuCl2 (秒)
方程式のバランスをとるには、係数を導入する必要があります:
2NaCl(a) + CuSO4 (aq) → Na2 SO4 (aq) + CuCl2 (aq)
次のステップは、全イオン方程式を書くことです:
2Na(aq) + 2Cl(aq) + Cu(aq) + SO4 (aq) → 2Na(aq) + SO4 (aq) + CuCl2 (秒)
反応矢印の両側で発生するイオンを探して、スペクテーター イオンを特定します。 Na と SO4 です .
2Na(aq) + 2Cl(aq) + Cu(aq) + SO4 (aq) → 2Na(aq) + SO4 (aq) + CuCl2 (秒)
観客のイオンを排除します:
2Na(aq) + 2Cl(aq) + Cu(aq) + SO4 (aq) → 2Na(aq) + SO4 (aq) + CuCl2 (秒)
これにより、正味のイオン方程式が残ります:
2Cl(aq) + Cu(aq) → CuCl2 (秒)
反応物で陽イオンが陰イオンの前に現れるように式を並べ替えます:
Cu(aq) + 2Cl(aq) → CuCl2 (秒)
観客イオンの重要性
正味の反応に関与したり、平衡に影響を与えたりすることはありませんが、スペクテーター イオンは重要です。それらの存在は、溶液中の電荷キャリアのデバイ長またはデバイ半径に影響を与えます。これが意味することは、これらのイオンが電気的スクリーンとして機能し、反対の電荷を帯びたイオンを引き付けるか、同じ電荷を帯びたイオンを反発することです。液体では、デバイ長は電解質とコロイドの伝導率に影響します。
参考文献
- アトキンス P.; de Paula、J.(2006)。 物理化学 (第8版)。 W.H.フリーマン。 ISBN 978-0-7167-8759-4.
- レイドラー、K. J. (1978)。 生物学的応用を伴う物理化学 .ベンジャミン/カミングス。 ISBN 978-0-8053-5680-9。
- ペトルッチ、ラルフ H.;ハーウッド、ウィリアム・S。 Herring, F. Geoffrey (2002)。 一般化学:原理と最新の応用 (第8版)。ニュージャージー州アッパーサドルリバー:プレンティスホール。 ISBN 978-0-13-014329-7.
- Zumdahl、Steven S. (1997)。 化学 (第4版)。マサチューセッツ州ボストン:ホートン ミフリン カンパニー。 ISBN 9780669417944.