クロム原子1個と酸素原子4個が結合してクロム酸塩になります。クロム酸の共役です。クロム酸塩は、クロム酸から 2 つのプロトンを除去することによって形成されるクロム オキソアニオンです。酸化剤として、さまざまな産業で応用されています。クロメート化成皮膜により光沢があり、地金の耐食性を高めます。また、非鉄表面への塗料の密着性を向上させる下地としても機能します。
クロメートとは?
クロム酸から形成されるクロムのオキソアニオンはクロム酸塩と呼ばれます。二価の無機陰イオンです。クロム酸アニオンを含むクロム酸の塩は、通常、濃い黄色をしています。最も広く使用されているクロム酸塩は、カリウム塩とナトリウム塩です。
- クロム酸塩の IUPAC 名:ジオキシド (ジオキソ) クロム
- クロム酸塩の化学式/クロム酸塩記号:CrO4
クロメート構造
クロメート構造には、1 つのクロム原子と 4 つの酸素原子があります。陰イオンはマイナス 2 の負電荷を持っています。
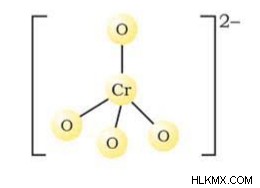
クロメートイオン
クロム酸イオンのルイス構造は、その結合電子と非結合電子を示しています。陰イオンには、2 つの一重共有結合と 2 つの二重共有結合があります。孤立電子対が 10 個あります。 4 つの酸素原子と 1 つのクロム原子があります。 2 つの酸素原子は、-1 の電荷を持っています。次の画像は、クロム酸イオンのルイス構造を示しています。
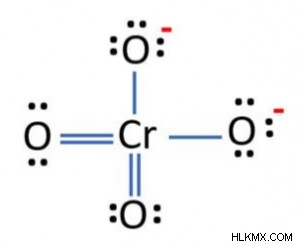
クロメートのルイス構造
クロム酸塩と重クロム酸塩の違いは何ですか?
クロム酸塩と二クロム酸塩は、クロムと酸素という同じ元素を含む 2 つの異なる陰イオンです。したがって、どちらもクロムのオキソアニオンです。ただし、この 2 つはまったく異なります。
それらの色には顕著な違いがあります。クロム酸塩は明るい黄色に見えますが、重クロム酸塩は明るいオレンジ色です。通常、高い pH 値、つまりアルカリ性媒体では多量のクロム酸塩が検出されますが、低い pH 値または酸性媒体では、より多くの重クロム酸イオンが検出される可能性があります。
次の表は、クロム酸塩と二クロム酸塩の主な違いを列挙しています:
| 特徴 | クロメート | 重クロム |
| 化学式 | クロム酸アニオンの化学式は CrO4 です . | 二クロム酸アニオンの化学式は Cr2 です O7 . |
| モル質量 | 115.99 g/mol | 215.99 g/mol |
| クロム原子 | イオンごとに 1 つのクロム原子があります。 | イオンごとに 2 つのクロム原子があります。 |
| 色 | 明るい黄色 | 明るいオレンジ色 |
| 発生 | それは通常、高い pH 値、つまり 6.5 以上で見られます。 | 低い pH 値、つまり 6.5 未満で発生します。 |
| 構造 | 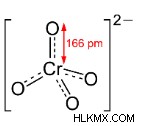 | 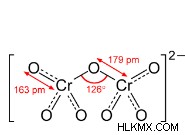 |
クロメートの物理的性質
- におい:無臭
- 分子量/モル質量:194.1896 g/mol
- 外観:黄色い粉
- 価数:-2
- 溶解度:水に不溶
- 密度:2.73 g/cm³
- 共役酸 :クロム酸 (H2 CrO4 )
- 酸化状態:+6
クロム酸塩の化学的性質
以下は、クロム酸塩が関与する重要な化学反応の一部です:
水との反応
クロム酸イオンは、酸性溶液中に存在する場合、強力な酸化剤です。ただし、アルカリ溶液では、水と結合して水酸化クロム(III)になります。
CrO4 + 4 H2 O + 3 e− → Cr(OH)3 + 5 オハイオ州-
硝酸バリウムとの反応
そのカリウム塩:クロム酸カリウムは、硝酸バリウムと反応します。反応のバランスの取れた化学式は次のとおりです:
K
硝酸銀との反応
クロム酸カリウムは硝酸銀と反応して、水性反応混合物中にクロム酸銀沈殿物を生成します。沈殿物は赤レンガ色です。反応のバランスの取れた化学式は次のとおりです:
2 AgNO3 (aq) + K2CrO4 (aq) → 2 KNO3 (aq) + Ag2 CrO4 (秒)
塩酸との反応
クロム酸カリウムは塩酸と強い反応を起こし、塩化カリウム、二クロム酸カリウム、および水を生成します。次の化学式は、反応を表しています:
2K
硝酸との反応
希硝酸とクロム酸カリウムを反応させて重クロム酸カリウムと硝酸カリウムを得る。その過程で水が放出されます。次の化学式は、反応を表しています:
2K
クロム酸カリウムの調製
クロム酸カリウムは、カリウム陽イオンとクロム酸陰イオンを含む無機塩です。次の化学式があります:K
以下の方法で準備できます:
重クロム酸カリウムと水酸化カリウムの反応
2モルの水酸化カリウムが1モルの重クロム酸カリウムと反応すると、2モルのクロム酸カリウムと水が得られます。反応の化学式は次のとおりです:
K
酸化クロムと水酸化カリウムの反応
水酸化カリウムが酸化クロムと反応すると、クロム酸カリウムが得られます。その過程で水が放出され、化学式は次のように表すことができます:
2 KOH + Cr2 O3 →2K
クロメートの使用
クロム酸アニオンとその塩は腐食性が高く、さまざまな産業で使用されています。
- エナメルには、クロム酸塩のナトリウム塩とカリウム塩が使用されています。
- 革の仕上げにも使用されます。
- 防錆金属に適しています
- 鮮やかな黄色のクロム酸カリウムの結晶は、染料やインクの顔料として使用されています。
- 工業用クレヨンはクロム酸鉛でできています。
- クロムメッキに使用すると、クロム酸イオンが腐食を防ぎます。優れた腐食防止剤です。
- 入門書として機能します。
- 装飾的な仕上げを与えるのに役立ちます。
- クロム酸イオンは電気伝導度の維持に役立ちます
- クロム酸カリウムは殺菌剤として使用されています。
- なぜクロム酸カリウムが指示薬として使われるのですか?
- クロム酸カリウムは、過剰な銀イオンが存在すると赤色に変化するため、沈殿滴定の指示薬として使用されます。
クロメートは有毒ですか?
クロメートは六価クロムです。六価クロムは、酸化状態が +6 のクロムを含む化合物です (つまり、六価)。六価クロム化合物はすべて有毒であり、クロム酸塩も有毒です。酸化力がその毒性の原因です.
特に空気中の場合、発がん性があります。したがって、人がクロム酸塩を吸い込むと、肺がんにつながる可能性があります.さらに、六価クロム化合物への曝露と鼻および鼻副鼻腔のがんとの間には、いくつかの正の関連性が発見されています.
重要なクロム酸塩化合物
クロメートは、いくつかの陽イオンと結合して、次のようないくつかの有用な化合物を形成します。
クロム酸鉛
- クロム酸鉛の化学式 :PbCrO4
- 鉛クロマトの分子量 e:323.1937 g/モル
- クロム酸鉛の用途 :絵の具や油絵具、水彩絵具の顔料として使用されます。セラミック、ゴム、プラスチックにも使用されます。
クロム酸カリウム
- クロム酸カリウムの化学式: K₂CrO₄
- クロム酸カリウムの分子量: 1896 グラム/モル
- クロム酸カリウムの用途: プライマーやコーティングの防食剤として使用されます。
クロム酸ストロンチウム
- クロム酸ストロンチウムの化学式: SrCrO4
- クロム酸ストロンチウムの分子量: 614 グラム/モル
- クロム酸ストロンチウムの用途: 金属基材の優れた腐食防止剤です。
クロム酸ナトリウム
- クロム酸ナトリウムの化学式: ナ2 CrO4
- クロム酸ナトリウムの分子量 :161.97 g/モル
- クロム酸ナトリウムの用途: 主に、皮革産業で使用されるクロム酸とクロム顔料の製造に使用されます。
亜鉛クロメート
- 亜鉛クロメートの化学式 :ZnCrO4
- クロム酸亜鉛の分子量 :181.403 g/モル
- 亜鉛クロメートの用途 :金属の下塗り塗料に使用されます。スプレー塗料、アーティスト用塗料、ワニスでも人気があります。リノリウムの製造に使用されます。
クロム酸バリウム
- クロム酸バリウムの化学式 :BaCrO₄
- クロム酸バリウムの分子量 :253.37 g/モル
- クロム酸バリウムの用途 :防食接合ペーストの顔料として使用されます。
クロム酸カルシウム
- クロム酸カルシウムの化学式: CaCrO4
- クロム酸カルシウムの分子量: 072 g/モル
- クロム酸カルシウムの用途: 酸化剤および腐食防止剤として広く使用されています。
クロム酸セシウム
- クロム酸セシウムの化学式 :Cs₂CrO₄
- クロム酸セシウムの分子量: 8 g/モル
- クロム酸セシウムの用途 :以前は真空管の作成に使用されていました。
クロミウムクロメート
- クロム酸クロムの化学式 :Cr2 (CrO4 )3
- クロム酸クロムの分子量: 99 g/モル
- クロミウム クロメートの用途 :航空機部品、亜鉛鋳物、亜鉛めっき鋼不動態化、マグネシウム鋳物に使用されます。
結論
クロム酸塩は、4 つの酸素と 1 つのクロム原子を含むオキソアニオンです。これは、クロム酸から 2 つのプロトンが除去された結果です。マイナス2のマイナス電荷を持っています。カリウムとナトリウムの塩は、独特の黄色をしているため、染色業界で広く使用されています。クロメートは強力な酸化剤です。どちらもクロムのオキソアニオンですが、クロム酸塩を重クロム酸塩と混同しないでください。
よくある質問
1.クロム酸塩は酸性または塩基性ですか?
A. クロム酸塩は、アルカリ溶液の主な種です。ただし、重クロム酸塩は酸性溶液中で優勢なイオンになる可能性があります。
2.クロム酸塩とクロムは同じですか?
A. いいえ、クロムはCrで表される原子番号24の元素です。色はグレーです。一方、クロム酸塩はクロムと酸素原子を含む陰イオンであり、CrO4 で表されます。 .その塩は黄色です。
3.クロムとクロメートの違いは?
A. クロム酸塩はクロムと酸素原子からなる陰イオンですが、クロムは元素クロムの短縮形です。この名前は、めっき業界で広く使用されています。クロムメッキは金属の上に重ねられたもので、クロムのみで構成されています。通常は研磨され、非常に光沢のあるコーティングが施されています。







