硫黄のオキシ酸について聞いたことがありますか?オキシ酸は、酸素原子を含む酸です。硫黄は、スルホキシル酸、亜硫酸、硫酸、ペルオキシ硫酸、チオン酸などのオキシ酸を形成します。硫黄のこれらのオキシ酸の中でどれが最も低いメンバーかわかりますか?その特性と構造は何ですか?その用途は何ですか?このセクションでは、硫黄オキソ酸の最低メンバーについて説明します。
亜硫酸とは?
硫黄は、その多数のオキシ酸で知られています。これらの酸は、遊離状態、溶液の形、または塩として存在します。
さて、質問に答えるために、亜硫酸とは何ですか?簡単に言えば、硫黄の酸素酸の一つと言えます。硫黄のオキシ酸は、3つのシリーズに分類されます。これら3つのシリーズのうち、1つは亜硫酸シリーズです。
最も弱いのは硫酸です。二酸化硫黄溶液は、硫酸の別名です。二塩基酸、つまり。硫酸では、S 原子は +4 の酸化状態にあります。この酸は不安定であるため、遊離型では見つけることができません。解決策でのみ理解されます。
亜硫酸構造
亜硫酸の分子式はH2SO3です。 OS(OH)₂と表記することもあります。亜硫酸の構造を以下に示します:
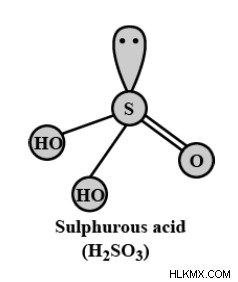
H₂SO₃ は、二酸化硫黄溶液、トリオキソ硫酸二水素塩、またはトリオキソ硫酸として知られています。ルイスドット構造の規則に従って、分子内で電気陰性度が最も低い S 原子が構造の中心にあります。化学者によって示唆されているように、2 つの亜硫酸構造があります。これらは
1.対称構造:
対称的な亜硫酸構造では、3 つの O 原子が S 原子を取り囲んでいます。 2 つの H 原子が 2 つの O 原子に結合して水酸基を形成します。そして、1 つの O 原子が S 原子と二重結合または配位結合を形成します。
2.非対称構造:
非対称亜硫酸構造では、S 原子は 3 つの O 原子と 1 つの H 原子に囲まれています。残りの H 原子は、水酸基を形成する任意の 1 つの O 原子に結合します。そして、他の 2 つの O 原子は、S 原子と 2 つの二重結合または配位結合を形成します。
通常、両方の亜硫酸構造は互いに共鳴して存在します。亜硫酸の形状は三角錐です。
亜硫酸の調製
亜硫酸は、水中の SO2 の溶液であると考えられています。亜硫酸を調製するには2つの方法があります。これらは
方法 1: 二酸化硫黄を使用。
酸の溶液は、水に SO₂ を溶解することによって得られます。
SO₂ + H₂O → H₂SO₃
方法 2: 塩化チオニルを使用。
H₂SO₃ は、塩化チオニル SOCl₂ に水を作用させることによっても調製できます。
SOCl₂ + 2H₂O → H₂SO₃ + 2HCl
亜硫酸の特性
いくつかの亜硫酸特性のリストを以下に示します:
<オール>H₂SO₃ ⇌ H₂O + SO₂
- SO₂ の飽和水溶液を H₂O で 3℃ に冷却すると、六水和物 SO₂・6H₂O の結晶が分離します。
- 酸性の性質: 二塩基性を示します。
H₂SO₃ ⇌ H⁺ + HSO₃⁻
HSO₃⁻ ⇌ H⁺ + SO₃²⁻
- 分解: 亜硫酸溶液を密閉管中で150℃に加熱すると硫黄が析出します。
3H₂SO₃ → 2H₂SO₄ + H₂O + S
- プロパティの削減: 強力な還元剤として作用します。特定の物質を還元すると、亜硫酸は H₂SO₄ に酸化され、発生期の水素が生成されます。
H₂SO₃ + H₂O → H₂SO₄ + 2[H]
- 酸化特性: また、酸化剤としても機能します。特定の物質を酸化すると、ほとんどの場合硫黄に還元されます。
H₂SO₃ → S + H₂O + 2[O]
- 漂白特性: 還元剤として作用するため、発生期の水素を容易に放出できます。この発生期の水素は、有色物質を無色物質に変えることができます。つまり、H₂SO₃ は漂白剤として機能します。
H₂SO₃ + H₂O → H₂SO₄ + 2[H]
- H₂SO₃ 分子は、酸素原子と硫黄原子を容易に取り込み、H₂SO₄ と H₂S₂O₃ (チオ硫酸) を形成します。
H₂SO₃ + [O] → H₂SO₄
H₂SO₃ + [S] → H₂S₂O₃
- 亜鉛粉の作用: H₂SO₃ を Zn ダストと一緒に加熱すると、次亜硫酸亜鉛 (ZnS₂O₄) が得られます。
H₂SO₃ + Zn → ZnS₂O₄ + 2H₂O
亜硫酸のその他の化学反応
<オール>H₂SO₃ + H₂O + X₂ → H₂SO₄ + 2HX
- KMnO4 の酸性溶液は、MnSO4 溶液に還元されます。
2KMnO₄ + 5H₂SO₃ → K₂SO₄ + 2MnSO₄ + 2H₂SO₄ + 3H₂O
- K₂Cr₂O₇ の酸性溶液は、Cr₂(SO₄)₃ の形成により緑色に変わります。
K₂Cr₂O₇ + H₂SO₄ + 3H₂SO₃ → K₂SO₄ + Cr₂(SO₄)₃ + 4H₂O
- 亜硫酸は Fe₂(SO₄)₃ を FeSO₄ に還元します。
H₂SO₃ + H₂O + Fe₂(SO₄)₃ → 2H₂SO₄ + 2FeSO₄
- ヨウ素酸塩の酸性溶液を I₂ に還元します。
5H₂SO₃ + 2KIO₃ → 4H₂SO₄ + K₂SO₄ + H₂O + I₂
- 亜硫酸は H₂S を S に酸化し、S に還元します。
H₂SO₃ + 2H₂S → 3S + 3H₂O
- 1000℃で、H₂ は H₂O に酸化され、H₂SO₃ は S に還元されます。
H₂SO₃ + 2H₂ → S + 3H₂O
- H₂SO₃ は自身を硫黄に還元し、SnCl₂ と Hg₂Cl₂ をそれぞれ SnCl4 と HgCl4 に酸化します。
H₂SO₃ + 2SnCl₂ + 4HCl → S + 3H₂O + 2SnCl₄
H₂SO₃ + 2Hg₂Cl₂ + 4HCl → S + 3H₂O + 4HgCl₂
中和亜硫酸
スルホン酸を中和するプロセスは、次の方法で実行されます:
<オール>商業運転では、このプロセスは断続的または連続的に実施することができる。
- 室温または通常の条件下で、亜硫酸は炭酸アルキルと反応します。また、亜硫酸を中和します。
- 50%苛性ソーダ溶液でも亜硫酸を中和できます。 50% 苛性ソーダ溶液と亜硫酸を反応させると、黄色がかったペーストが得られます。
亜硫酸の使用
亜硫酸の存在を証明するものはほとんどないため、亜硫酸の使用がいくつかあります.これらは
- 亜硫酸は強力な還元剤です。亜硫酸が他の物質を還元すると、+6 まで酸化できる +4 の酸化状態を持っています。
- 塩素を塩酸に還元できます。
- 別の酸素原子を受け入れることで、硫酸塩または硫酸に酸化できます。
- 帽子やバッグなどのストローや紙製品の漂白に使用されます。
- 優れた消毒剤として使用されます。
亜硫酸の毒性
亜硫酸の使用とは別に、いくつかの毒性の問題があります。不利なケースでは、
- それは皮膚毒素であり、皮膚の火傷を引き起こす可能性があります.
- また、有毒なガスや蒸気、または金属煙の吸入によって影響を受ける肺の炎症を引き起こすこともあります.
- 下痢、運動亢進などの胃腸の問題を引き起こすこともあります.
- 亜硫酸ガスを吸入した後に吐き気や嘔吐を経験した場合のいくつかの事例が記録されています.
亜硫酸に関する注意事項
- その純粋な形は利用できません。
- 治療キツオで知られる貧弱な無機酸です。
- 水中の二酸化硫黄溶液と見なされます.
- 三角錐構造です。
- 溶液は SO₂ のにおいがします。
- ソリューションの形で存在します。
- スルホン酸の互変異性体です。
- 燃焼すると刺激的な硫黄臭がします。
- SOCl₂ を水と反応させても得られます。
- 150℃で加熱すると、水、硫酸、硫黄に分解する.
- 亜硫酸の主成分は酸性雨です。
- H₂SO₃ の沸点は -60℃です。
- 組織や金属に対して腐食性があります。
- これは二塩基酸であり、2 つの陽子、つまり 2 つの H⁺ イオンを供与できます。
- 亜硫酸水素塩の共役酸です。
- 亜硫酸のモル質量は 82.07 g/mol です。
結論
結論として、亜硫酸は硫黄オキソ酸です。この酸が溶液中に存在することを直接証明する文書はありませんが、分子は気相で検出されています。亜硫酸は、硫黄の研磨性オキソ酸であり、スルホン酸の互変異性体です。純粋な無水亜硫酸 (H2SO3) は概説できないため、二酸化硫黄水溶液はしばしば亜硫酸と呼ばれます。
それらは還元剤および消毒剤として使用されます。有毒な硫黄の発がん性ガスを放出するため、亜硫酸は硫黄の発がん性酸です。その煙を吸い込んだり、亜硫酸と接触した場合は、医師の診察を受ける必要があります。
よくある質問
<強い>1.亜硫酸は強いですか、それとも弱いですか?
A. 弱酸は水中で部分的に解離し、弱酸とそのイオンを含む平衡状態になります。水性状態の H2SO3 は、H3O+ または H+ と亜硫酸水素イオンに完全には解離しません。これは、水などの塩基がある場合、重亜硫酸イオンがプロトン (H + ) を保存するのに比較的強いことを意味します。したがって、亜硫酸 (H₂SO₃) は弱酸です。
<強い>2.亜硫酸は健康被害を引き起こしますか?
A. 亜硫酸は腐食性の薬品です。用途以外にも、亜硫酸は健康被害を引き起こします。
- 亜硫酸と直接接触すると、重度の刺激や皮膚の火傷を引き起こす可能性があります.
- 目にダメージを与えることさえあります.
- 吸入すると、亜硫酸は喉や鼻を刺激する可能性があります。
- 呼吸する亜硫酸、H₂SO₃ は肺を刺激する可能性があります。
- 咳や息切れを引き起こすこともあります。
<強い>3.亜硫酸と硫酸のどちらの酸が強いですか?
A. 亜硫酸 (H₂SO₃) と硫酸は二塩基酸で、分裂すると 2 つのプロトン (H++) になります。それでも、硫酸 (H2SO4) は強力な酸です。これは、H₂SO₃ と比較して、最初のプロトン解離が最も優先されるためです。







