ナトリウムの次に反応性の高い金属を知っていますか?いいえ?カリウムです!カリウムはナトリウムと似ています。つまり、非常に反応性が高く、柔らかく、活発です。その反応性のために、灯油に保管されます。ナトリウムと同様に、カリウムも酸素と反応して酸化カリウムを形成します。しかし、あなたは答えることができますか?酸化カリウムはイオン性ですか、それとも共有結合ですか?この化合物は酸性ですか、それとも塩基性ですか?酸化カリウムの用途は?
このセクションでは、酸化カリウムに関するすべての質問を解決できます。
酸化カリウムとは?
酸化カリウムは、酸素とカリウムが結合してできた化合物です。酸化二カリウムまたは一酸化カリウムとしても知られています。無機化合物です。酸化ナトリウムと同様に、酸化カリウムも反応性が高く、めったに見られない化合物です。
酸化カリウムがイオン性か共有結合性かは簡単に推測できます。まず、カリウムは金属であり、金属は電気的に陽性ですが、酸素は非常に電気陰性度の高い元素の 1 つです。そのため、分極が発生し、形成された化合物はイオン性です。
第二に、それはさらに説明される酸化カリウムのルイス構造によって説明されます。
酸化カリウムの構造と式
酸化カリウムの分子式はK₂Oです。酸化カリウムを総称してアルカリ金属酸化物といいます。これは、反応性の高いカリウムの最も単純な化合物です。
この化合物はイオン性化合物です。これは、カリウムの最外殻に電子が 1 つしかなく、酸素が 2 つの電子に満たないため、オクテットが満たされないためです。したがって、2 つのカリウム原子が電子を酸素原子に供与し、イオン結合を形成します。その結果、化合物の形もイオン性になります。
酸化カリウムのルイス構造を以下に示します:
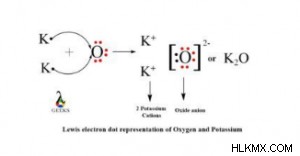
カリウム イオンは +1 の電荷を持ち、酸素イオンは -2 の電荷を持ちます。電気的に中性の化合物の場合、電荷は互いに釣り合う必要があります。したがって、O 原子の -2 電荷のバランスを取るには、2 つの K 原子が必要です。その結果、酸化カリウムの化学式は K₂O になります。
酸化カリウムの調製
酸化カリウムを調製するいくつかの方法は
1.過酸化カリウムの助けを借りて:
- 得られる生成物は、過酸化カリウム (K₂O₂) をカリウム金属と反応させると酸化カリウムになります。
K₂O₂ + 2K → 2K₂O
- 過酸化カリウムを 500°C で加熱すると、純粋な酸化カリウムと酸素分子に分解します。
2K₂O₂ → 2K₂O + O₂ ↑
2.硝酸カリウムの助けを借りて:
硝酸カリウムをカリウム金属で処理すると、窒素ガスを放出して酸化カリウムが得られます。この方法は最初の方法より有利です。
2KNO₃ + 10K → 6K₂O + N₂ ↑
3.水酸化カリウムの助けを借りて:
水酸化カリウムは、酸化物にさらに脱水することはできません。しかし、溶融カリウムと反応して酸化カリウムを生成し、副産物として水素を放出する可能性があります.
2KOH + 2K ⇌ 2K₂O + H₂ ↑
4.カリウム金属の助けを借りて:
カリウム金属が酸素と反応すると、酸化カリウムになります。この反応は次のように表されます
4K + O₂ → 2K₂O
酸化カリウムの物性
カリウムは、周期表のグループ I であるナトリウム族のメンバーです。電子を放出することにより、そのオクテットを完成させる傾向があります。そのため、遊離型では非常に反応性が高くなります。酸素で処理すると、O原子と容易に結合し、酸化カリウムを形成します。酸化カリウムのいくつかの物理的性質は次のとおりです:
- 淡黄色または白色の結晶性の固体化合物です。
- 酸化カリウムのモル質量は 94.2 g/mol です。
- 肥料として広く使用されています。
- 水よりも密度が高い。酸化カリウムの密度は 2.35 gm/cm³ です。
- 無臭の化合物です。
- 740°C で分解します。
- エタノールとジエチルエーテルに溶けます。
- 酸化カリウムの熱容量は 83.62 J/mol·K です。
- 酸化カリウムの分子はアンチフルオライト構造を形成します。
酸化カリウムの化学的性質
化合物の化学的性質は、化合物の化学組成を変える性質です。カリウムは反応性の高い金属であるため、酸化カリウムは反応性化合物であり、激しく反応する可能性があります.
- 酸化カリウムと過剰な水を反応させると腐食性が強くなり、化合物は水酸化カリウムを形成します。
K₂O + H₂O → KOH
- それは金属酸化物であり、一般に金属酸化物は塩基性です。したがって、それは塩基性またはアルカリ性であり、非常に腐食性があります。
- 酸化カリウムが強酸と反応すると、塩と水になります。この反応は、酸化カリウムが塩基性化合物であることを示しています。
K₂O + HCl → KCl + H₂O
K₂O + H₂SO₄ → K₂SO₄ + H₂O
K₂O + HNO₃ → 2KNO₃ + H₂O
これらの反応は中和反応の例です。
- 300°C 以上に加熱すると、酸化カリウムは過酸化カリウムとカリウム金属に変換されます。
2K₂O → K₂O₂ + 2K
酸化カリウムの用途と応用
それは非常に活発で、湿気と容易に反応します。さまざまな目的で使用されます。それらのいくつかは
- 農業では、酸化カリウムが肥料として広く使用されています。
- ガラス製造やセメント製造業界でも使用されています。
- 酸化カリウムは水に不溶で、安定性の高い化合物です。この特性は、セラミック業界で便利です。
- 動物関連の病気の治療に動物医が使用しています。
- 一般に、それは純粋なカリとして知られており、グラスや石鹸の調製に使用されます.
- 航空宇宙産業では、構造化合物や軽量ボウルの製造に酸化カリウムが使用されています。
- 接合菌などの真菌感染症と同様に、酸化カリウムはそのような感染症の治療に使用されます。
- 少量ですが、酸化カリウムは一部の医薬品にも使用されています。
酸化カリウムの安全対策
酸化カリウムはさまざまな用途に役立ちますが、反応性が高いため危険な化学物質です。そのため、作業中は注意が必要です。ただし、なんらかの形で酸化カリウムに触れた場合は、すぐに応急処置を行う必要があります。これらは
1.酸化カリウムが目に入った場合:
- すぐに多量の水で少なくとも 30 分間、目を洗い流してください。
- まぶたを上下に持ち上げて目を洗います。
- 目を洗うとき、コンタクトレンズを着用している場合は外してください。
- 直ちに医師の診察を受けてください。
2.皮膚が酸化カリウムに触れた場合:
- 汚染された衣服はできるだけ早く脱いでください。
- 汚染された場所をすぐに大量の水で洗い流してください。
- 直ちに医師の診察を受けてください。
3.酸化カリウムを吸入した場合:
- 酸化カリウムにさらされた人物をその場所から退去させる
- 呼吸が止まっている場合は、人工呼吸をして応急処置を開始してください。
- 心臓の機能が停止している場合は、心肺蘇生を行います。
- 速やかに医療施設に搬送してください。
結論
上記の記事を読んだ後、酸化カリウムについて十分な情報が得られました.酸化カリウムは、反応性の高い特性を持つ無機酸です。酸化カリウムの化学式はK₂Oです。塩基性またはアルカリ性の性質を持っています。強酸で処理すると中和反応を起こします。そのさまざまな特性により、主に農業の肥料として使用されます。ガラス、セラミック、および光学産業で役立ちます。摂取して吸入すると有毒になります。毒性があるため、作業中は注意が必要です。
よくある質問
1.カリウムは空気に触れると何種類の酸化物を形成しますか?
A. カリウムが空気(酸素)に触れると、3 種類の酸化物を形成します。酸化物の形成は、反応中の酸素の利用可能性に依存します。
<オール>反応は次のように起こります
8K + 4O₂ → 2K₂O+ 2KO₂ + K₂O₂
2.超酸化カリウムとは?
A. 超酸化カリウムは、化学式 KO₂ を持つ無機化合物です。 KO₂、カリウムスーパーオキサイドの酸素の酸化状態は-1です。湿った空気中で分解する黄色の常磁性固体です。酸化カリウムや過酸化カリウムとは異なる化学的および物理的特性を持っています.
3.酸化カリウムは健康被害を引き起こしますか?
A. 酸化カリウムは、化学式 K₂O の無機化合物です。湿気や空気中で腐食性が高く、活発です。そのため、化学反応中や作業中は、注意して安全に取り扱う必要があります。酸化カリウムによって引き起こされるいくつかの健康被害は
- 皮膚に付着すると、皮膚刺激を引き起こす可能性があります。
- 酸化カリウムが目に入ると、目に深刻な損傷を与える可能性があります。
- 吸入すると、咳や息切れを引き起こす可能性があります。
- 吸入すると、鼻、のど、肺を刺激する可能性があります。
そのため、酸化カリウムを扱う実験室での作業中は、手袋、白衣、安全メガネを着用する必要があります。
4.酸化カリウムを水に溶かしたとき、形成される溶液の pH は?
A. 酸化カリウムはイオン性化合物であり、塩基性を持っています。水に溶けると、K⁺ イオンと OH⁻ イオンに完全に分解されます。 [OH⁻] イオンの濃度は、溶液の pH を計算するために使用されます。
pH =14 – pOH
pH =14 – 1.48 =12.52
したがって、形成される溶液の pH は 12.52 になります。