アセトンとは何?アセトンは可燃性の高い有機化合物で、化学式は C3 です。 H6 O. アセトンの別名はプロパノンです。植物、車両、森林火災、樹木の排気ガスから生成されます。また、人体でも生成され、血液や尿に含まれています。アセトンは、エタノール、水、エーテルに混和する無色の揮発性化合物です。刺激臭や刺激臭があり、溶剤や防腐剤として幅広い用途があります。アセトンについてもっと知りたい場合は、読み進めてください!
アセトンは、金属酢酸塩の乾留によって錬金術師によって最初に生成されました。現在、アセトンはプロピレンから直接的または間接的に製造されています。アセトンの約 80% は、クメン法と呼ばれるプロセスで製造されます。また、クメンを調製するいくつかの古い方法が存在します。
アセトン構造
以下は、アセトン構造の表現です:
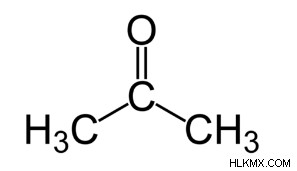
アセトン式はC3 H6 OまたはCH3COCH3。これは、水素原子 6 個、炭素原子 3 個、酸素原子 1 個を含む最も単純な既知のケトンです。 2 つのメチル基は、アセトン化合物の原子の中央の炭素原子に結合しています。この炭素原子はまた、ケトンまたはカルボニル官能基を形成することにより、酸素原子と二重結合を形成します。アセトンの構造には、利用可能な 2 つの原子価があり、どちらも炭素原子に結合しています。したがって、化合物中のケト基は鎖内に存在します。
アセトンの調製
産業におけるアセトンの約 80% は、クメン プロセスとして知られるプロセスによって生成されます。ここでは、ベンゼンをプロピレンでアルキル化してクメンを生成し、空気で酸化してアセトンとフェノールを生成します。
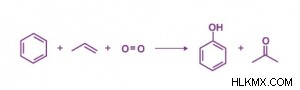
アセトンの生産
- 業界では、イソプロパノールから、酸化亜鉛または銅による接触脱水素によってアセトンを生成できます。また、銀触媒を触媒的に酸化することでも生成することができます。
- アセトンは、加圧下で酸素とプロパンの混合物を塩化第二銅とパラジウムの水溶液に通すことによって得られます。
- 天然ガスの酸化によって生成されます。
- すべてのプロセスの中で、2-プロパノンとフェノールを製造するための最も重要なプロセスは、クメン フェノール プロセスです。これは、クメンを酸化してヒドロペルオキシドにすることによって実行されます。次に、このヒドロペルオキシドを希硫酸で分解して、2-プロパノールとフェノールを生成します。
アセトンの一般的性質 – C3 H6 ああ
アセトンの物理的性質
| アセトンのモル質量 | アセトンのモル質量は 58.08 g·mol−1 |
| 外観 | 室温で無色の液体 |
| 臭い | 刺激性または刺激性 |
| 融点 | -94.6 °C (-138.5 °F; 178.5 K) |
| 密度 | 0.7846 g/㎤ |
| 沸点 | 56.04 °C (132.89 °F; 329.20 K) |
| 磁化率 (χ) | −33.78・10−6㎤/mol |
| 水への溶解度 | 混和性 |
| 他の液体への溶解度 | ジエチルエーテル、エタノール、ベンゼン、メタノール、クロロホルムに混和 |
| 屈折率 (nD) | 1.3588 |
| 粘度 | 0.295 mPa·s (25 °C) |
| アセトンフォーミュラ | C3 H6 その他 |
アセトンの化学的性質
ケト/エノール互変異性:
アセトンは、その最も重要な化学的性質の 1 つであるケト - エノール互変異性を示します。 -カルボニル基を含むいくつかの分子は、α-水素の酸性度による互変異性として知られるプロトン移動平衡を示します。互変異性体は、容易に相互変換可能な構造異性体であり、原子または基の異なる位置によって区別されます。
互変異性体では原子の再配置があるため、非共有電子対または結合の位置のみが異なる共鳴形式とはまったく異なります。ケト/エノール互変異性という用語では、「ケト」は互変異性体がカルボニル結合を含むことを示し、「エノール」はヒドロキシル基または二重結合の存在を示します。
ケト-エノール互変異性化の平衡点は、ケト互変異性体とエノール互変異性体の両方の安定化因子に依存します。単純なカルボニル化合物の通常の条件下では、平衡は通常、ケト互変異性体を強く支持します。ケト互変異性体はエノール互変異性体よりも約46~59kJ/molだけ安定であるので好ましい。安定性は、C=O 二重結合が C=C 二重結合よりも安定で強いという事実によるものでもあります。
また、ケトンには、カルボニル基の炭素に電子を供与する 2 つのアルキル基が含まれています。したがって、安定性が高く、アルデヒドに比べてエノール互変異性体を形成しにくい。たとえば、プロパナールはアセトンよりも何千倍もエノール互変異性体になりやすい.カルボン酸の誘導体では、カルボニルは電子の供与によって脱離する基によって安定化されるため、エノール互変異性体の生成がはるかに困難になります。一般に、ケトンはエステルよりもエノール互変異性体である可能性が 100,000,000 倍高くなります。以下は、アセトンによって示されるケト互変異性を表したものです:

ハロホルム反応
アセトンにはCH3が含まれているため -C=O基の場合、ハロホルム反応を示します。これは、アルカリの存在下でハロゲンと反応して酸塩とハロホルムを生成することを意味します。
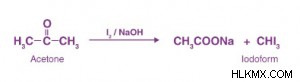
ハロホルム反応機構
以下は、ハロホルム反応の段階的な説明です:
ステップ 1
アルファ水素は、エノラートを生成するために塩基 (水酸化物イオン) によって取り出されます。この後、ハロゲンとエノラートとの反応が起こり、ハロゲンに対応する陰イオンに加えてハロゲン化ケトンが形成されます。
ステップ 2
ステップ 1 を 2 回繰り返して、トリハロゲン化ケトンを生成します。
ステップ 3
水酸化物イオンは求核剤として機能し、二重結合の求電子性炭素を攻撃します。二重結合は炭素と酸素の間にあります。反応後、それは単結合に変化し、酸素原子を陰イオンにします。これにより、炭素-酸素二重結合の再形成が促進され、3 つのハロゲンに結合した炭素が置換され、カルボキシル基が残ります。この後、酸塩基反応が起こり、カルボン酸によるプロトンがトリハロメチルアニオンに供与され、必要なハロホルム生成物が得られます。
アセトンの使用
アセトンは、繊維および製薬産業、研究所、および日常的に使用される家庭用製品の製造において幅広い用途があります。また、メチルメタクリレートとメチルイソブチルケトンの製造にも使用されます。アセトンは、化学研究や分析産業の分野でも幅広い用途があります。
溶剤としての用途: アセトンは、セルロース、ラッカー、アセチレン、酢酸セルロースの溶媒として使用されます。ポリエステル樹脂の製造に使用される一部のプラスチックや合成繊維の優れた溶剤として機能します。ワニスや塗料の製造にも使用されます。
医療用途: アセトンは、正確な投与量を確保するために、医薬品の製造における溶媒として使用されます。また、医療器具や機器の消毒や滅菌にも使用されています。皮膚科医は、剥離した皮膚に存在するにきびに対処するためにアセトンを使用します.
アセトンの国内使用: アセトンには多くの国内用途があります。スキン クリームや化粧品の添加剤として使用されたり、瞬間接着剤やネイル ペイント リムーバーの主成分として使用されたり、ABC プラスチック モデルや 3D プリント モデルに造形物をプリントしたりするために使用されます。アセトンは、電化製品やガジェットの洗浄を目的とした洗浄剤に使用されています。
結論
この記事が、アセトンの構造、アセトンの式、アセトンのモル質量、アセトンとは何か、その物理的および化学的特性とは何か、その用途とは何か、および実験室での調製方法についての基本的な理解を得るのに役立つことを願っています.最後までに、このトピックに関するほとんどの質問に答えられることを願っています。
よくある質問
1.化学研究の分野でのアセトンの用途は何ですか?
A. アセトンは実験室で極性溶媒の形で幅広い有機化学反応に使用されます。安価で揮発性が低いため、実験装置の洗浄用溶剤として一般的に使用されています。アセトンは、化学研究所でもタンパク質の沈殿に使用されます。
2.分析産業の分野でのアセトンの用途は何ですか?
A. 分析産業の分野では、アセトンは良好な色素溶媒としてクロマトグラフィー研究に使用されます。溶解度が高いため、ガスクロマトグラフィー、薄層クロマトグラフィー、高速液体クロマトグラフィーの手順にも使用されます。
3.アセトンは除光液として使用できますか?
A. アセトンは強力な溶剤であるため、ネイルペイントリムーバーとして使用されます。さらに、スーパーグルーリムーバーとしても使用できます。また、ネイルペイントの準備やさまざまな種類の油の除去にも効果的に使用されます。
4.アセトンは有毒ですか?
A. 中程度から多量のアセトンを一定期間吸入すると、鼻、肺、のど、および目の炎症を引き起こす可能性があります。また、めまい、頭痛、急速な脈拍、錯乱、嘔吐、吐き気、意識喪失、血液への影響、女性の月経周期の変化、最悪の場合は昏睡を引き起こすこともあります。