主な違い – アルコールとカルボン酸
アルコールとカルボン酸は有機化合物です。それらは、さまざまな組み合わせのC、H、およびO原子で構成されています。これらの化合物は両方とも酸性化合物です。それらは、官能基と呼ばれる原子の特別なグループを持っています。アルコールとカルボン酸の違いは、これらの官能基の存在によって識別できます。これらは異なる化合物であるため、この記事で説明したように、異なる物理的および化学的特性を示します。実験室や産業では、アルコールとカルボン酸の多くの用途があります。アルコールとカルボン酸の主な違いは、 アルコールに存在する官能基はヒドロキシル基 (-OH) ですが、カルボン酸の官能基はカルボキシル基 (-COOH) です。
対象となる主な分野
1.アルコールとは
– 定義、例を含むさまざまな形式、プロパティ、および反応
2.カルボン酸とは
– 定義、例を含むさまざまな形式、プロパティ、および反応
3.アルコールとカルボン酸の類似点は何ですか
– 共通機能の概要
4.アルコールとカルボン酸の違いは何ですか
– 主な相違点の比較
重要な用語:アルコール、カルボキシル基、カルボン酸、水素結合、ヒドロキシル基、極性
アルコールとは
アルコールは、1 つ以上の水酸基 (-OH) から構成される有機化合物です。アルコールは、アルキル基とヒドロキシル基に配置されたC、H、およびO原子で構成される分子です。ヒドロキシル基は、アルキル基の 1 つの炭素原子に結合しています。
アルコールはさまざまな方法で合成できます。さらに、アルコールは、他の有機化合物の合成の出発分子または中間体として機能します。一部の飲料には、主成分または微量成分としてアルコールが含まれています。アルコールは、不純な混合物から化合物を精製するための溶媒として使用できる場合があります.
アルコールの構造を考えるとき、アルコールの構造には大きく分けて 3 つのタイプがあります。構造と各構造の例を以下に示します。
第一級アルコール
第一級アルコールは、1 つのアルキル基のみに結合しているアルキル基の炭素原子に結合しているヒドロキシル基で構成されています。
例:エタノールは、炭素原子に結合したヒドロキシル基で構成されています。
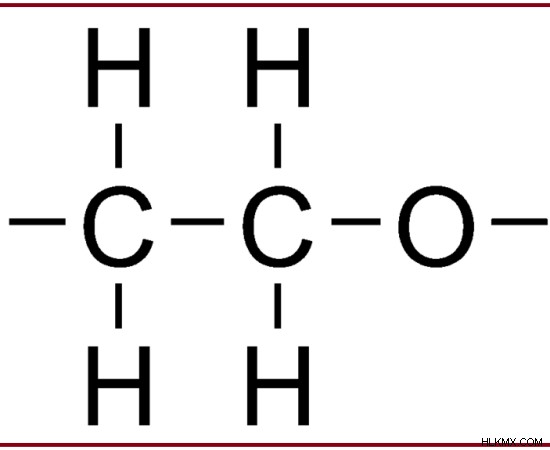
図 1:第一級アルコール – エタノール
二次アルコール
第二級アルコールは、ヒドロキシル基と他の 2 つのアルキル基に結合した炭素原子で構成されています。
例:2-ブタノールは 2 級アルコールです。
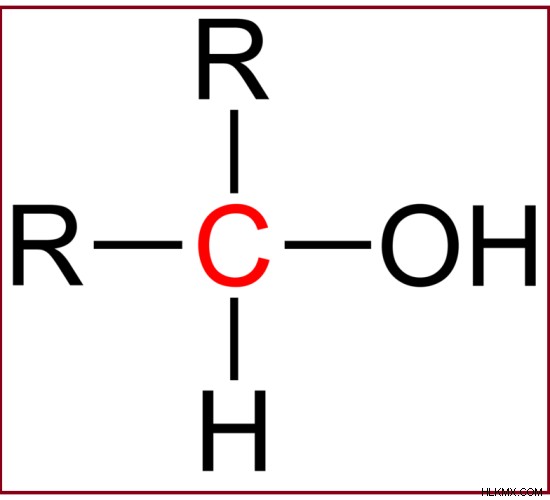
図 2:2 級アルコールの一般的な構造。ここで「R」基はアルキル基を示します。
三級アルコール
第三級アルコールは、ヒドロキシル基に結合した炭素原子と 3 つのアルキル基で構成されています。
例:2,2-メチルブタノール
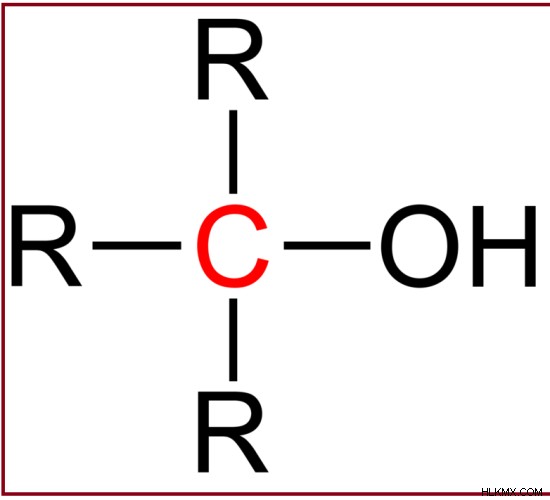
図 3:第三級アルコールの一般的な構造
-OH基が存在すると酸性になりますが、アルコールは弱酸です。これらの-OH基は、アルコールの水素結合を引き起こします。あるアルコールの-OH基の酸素原子と別のアルコールの水素原子の間に水素結合があります。これらの水素結合により、アルコールの沸点が高くなります。ただし、アルコールの沸点は、アルコールに存在する炭素原子の数とともに上昇します。さらに、アルコールは水に完全に溶けます。これは、アルコール分子が水分子と水素結合を形成できるためでもあります.
アルコールは、アルケンの水和、アルデヒド、ケトン、酸、およびエステルの還元によって合成できます。アルコールに関連する主要な化学反応の 1 つは、-OH 基の H 原子をナトリウム (Na) などの求電子剤で置換することです。ここで、Hがアルキル基で置換されている場合、最終生成物としてエーテルが得られます。同様に、脱離反応、求核置換など、アルコールが受けることができる多くの反応があります。
カルボン酸とは
カルボン酸は、カルボキシル基 (-COOH) から構成される有機化合物です。カルボン酸の化学式は、R-COOH で表すことができます。ここで、「R」はアルキル基を表します。カルボキシル基の存在は、分子がカルボン酸であることを示します。
その名の通り、カルボン酸は酸です。それらは、酢、柑橘類、薬などの多くの食品に含まれています。最も単純なカルボン酸はHCOOHです。これは一般にギ酸と呼ばれます。 R基がメチル基(-CH3)で置換されている場合 )、それは酢酸を与えます。
カルボン酸は、カルボキシル基が存在するため極性分子です。したがって、極性溶媒によく溶けます。さらに、カルボン酸は水素結合を形成する能力があるため、水に溶けます。カルボン酸は、2 つのカルボン酸の間に 2 つの水素結合を持つことができ、カルボン酸の二量体を形成します。これは「自己結合」と呼ばれます。
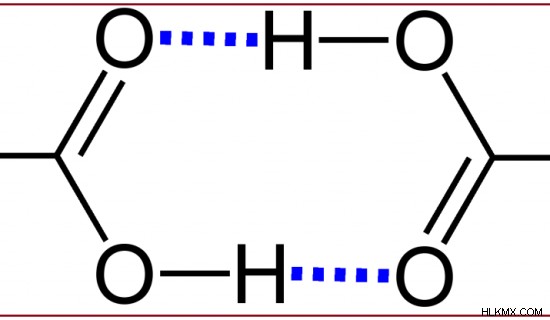
図 4:カルボン酸の二量体
カルボン酸は、二量体の形成により安定性が増すため、沸点が高くなります。カルボン酸の酸性度は、カルボン酸の H がプロトンとして放出されるときに発生します。このプロトン放出により、システムの pH が上昇し、酸性の挙動を示します。
CO2を処理することでカルボン酸を合成できる グリニャール試薬で。カルボン酸は、金属を形成する金属カルボン酸塩および水素ガスと容易に反応することができます。カルボン酸と金属水酸化物との間の反応も、金属カルボン酸塩を生成することができる。もう 1 つの重要な反応は、カルボン酸とアンモニアの反応です。
アルコールとカルボン酸の類似点
- アルコールとカルボン酸は有機化合物です。
- どちらの化合物も酸性の性質を示します。
- どちらも C、H、O 原子で構成されています。
- アルコールもカルボン酸も極性化合物です。
- 両方の分子が水素結合を形成できます。
アルコールとカルボン酸の違い
定義
アルコール: アルコールは、1 つ (または複数) のヒドロキシル基 (-OH) から構成される有機化合物です。
カルボン酸: カルボン酸は、カルボキシル基 (-COOH) から構成される有機化合物です。
酸素原子の数
アルコール: アルコールは、1 つの官能基につき 1 つの酸素原子を持っています。
カルボン酸: カルボン酸には、1 つの官能基あたり 2 つの酸素原子があります。
機能グループ
アルコール: アルコールは、官能基として –OH を持っています。
カルボン酸: カルボン酸は、官能基として –COOH を持っています。
沸点
アルコール: アルコールは、対応するカルボン酸よりも沸点が低くなります。
カルボン酸: カルボン酸は、対応するアルコールよりも沸点が高くなります。
二量体形成
アルコール: アルコールは二量体を形成できません。
カルボン酸: カルボン酸は二量体を形成できます。
酸度
アルコール: アルコールは弱酸です。
カルボン酸: カルボン酸は、対応するアルコールよりも酸性です。
結論
アルコールとカルボン酸は有機化合物です。どちらもC、H、O原子でできていますが、構造や性質が異なります。アルコールとカルボン酸の主な違いは、アルコールに存在する官能基がヒドロキシル基 (-OH) であるのに対し、カルボン酸の官能基はカルボキシル基 (-COOH) であることです。