同位体は同じ元素の異なる形です .元素の同位体は同じ数の陽子を持っています と電子ですが、中性子の数が異なります .
これは、原子番号 (陽子の数) は同じですが、質量数 (陽子と中性子の数) が異なることを意味します。
紙皿同位体モデル
これらの非常に単純な紙皿モデルは、Carbon-13 と Carbon-12 の違いを示しています。余分な 2 つの中性子が不安定になるため、放射性の炭素 14 もあります。

覚えておいてください – 要素は常に同じ原子番号を持ちます ( 陽子の数 ) ですが、 質量数 (陽子と中性子の数) は異なる場合があります。

同位体の例
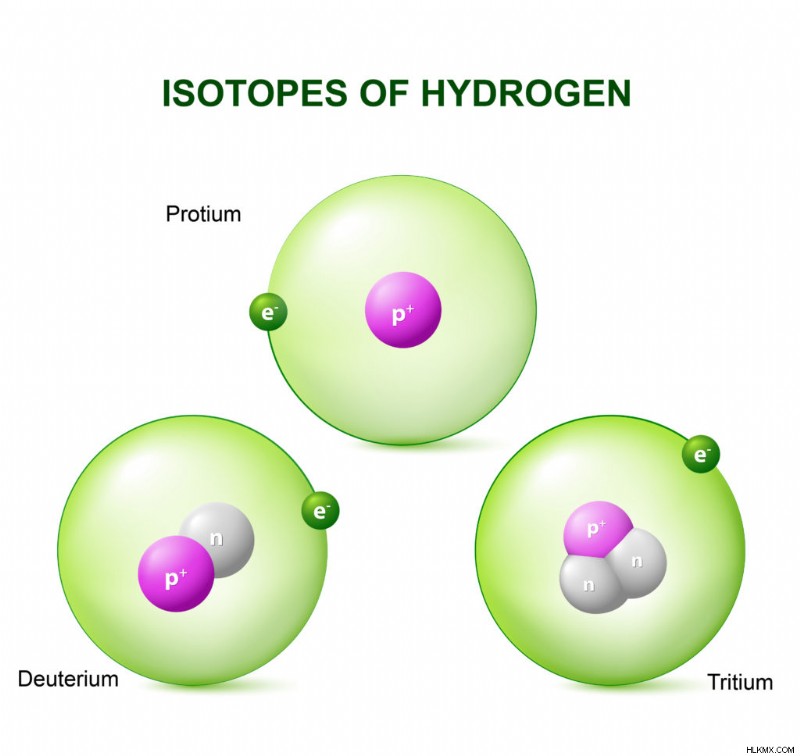
水素の同位体
水素 -1
水素-2
水素-3
水素の最も一般的な形態はプロチウムです。 Protium には中性子がありません。
重水素には 1 個の中性子があり、トリチウムには 2 個の中性子があります。
トリチウムは放射性です。
同位体に関する事実
スズ あらゆる元素の中で最も安定した同位体を持っています。
同位体の質量は、陽子の数に中性子の数を加えたものです。
水素は、同位体に独自の名前がある唯一の元素です!
セシウムとキセノンは、それぞれ 36 の最も自然に存在する同位体を持っています!
不安定同位体は放射性です。