コア コンセプト
ガルバニ電池に関するこのチュートリアルでは 、別名ボルタ電池 では、レドックス反応の基礎と、この情報を電気化学セルに適用する方法を学びます。また、どの電極でどの半反応が起こるかを決定し、これらの標準的な半反応電位を使用して細胞電位を計算する方法も学びます。
電気化学セルには、ガルバニ電池とも呼ばれるボルタ電池と電解電池の 2 種類があります。ボルタ電池は電気を生成しますが、電解電池は電源を使用して反応を進めます。
他の記事で取り上げるトピック
- 電気化学とは
- 標準削減の可能性
- 電解セル
- レドックス反応のバランスをとる
- 酸化数の計算
酸化還元反応の基礎
電気化学プロセスでは、電子は、酸化還元 (レドックス) 反応として知られているもので、ある物質から別の物質に流れます。酸化還元反応は、酸化剤と呼ばれる物質が電子を奪って還元されることで、別の物質を酸化するときに起こります。酸化還元反応では、電子の移動の方向を覚えておくための簡単なニーモニックは「Oil Rig」です。これは、酸化では種が電子を失い、還元では種が電子を得るという事実を指します。
酸塩基反応のような酸化還元反応ではない反応では、元素の酸化状態は変化しません。
酸化反応の簡単な例は、次のような酸化鉄 (II) と一酸化炭素の反応です:

この反応では、鉄は酸化状態が +3 から 0 に還元され、炭素は酸化状態が +2 から +4 に酸化されます。すべてのレドックス反応では、1 つの種が酸化され、1 つの種が還元されます。
バナジウムなどの一部の元素は、酸化還元反応が進行するにつれて、複数の酸化状態を経ることさえあります.
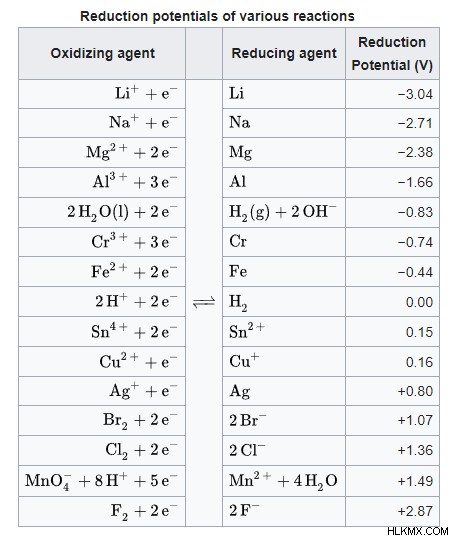
削減の可能性
電圧とも呼ばれる電位は、電気化学において非常に重要な概念です。これは、1 クーロンの電荷によって伝達されるエネルギーをジュール単位で表します。原子やイオンを含むすべての化学種は、電子を受け入れる特定の「意欲」を持っています。これは標準削減ポテンシャルと呼ばれます 、ボルト (J/C) で測定されます。還元電位は、電気陰性度や電子親和力とは異なりますが、両方に関連しています。削減の可能性が肯定的であるほど、削減が有利になります。
還元半反応は原子・イオンが電子を受け取る過程であるため、その半反応の良し悪しは還元電位で表すことができます。逆に、酸化半反応は電子を受け取るのと逆なので、還元電位のマイナスで表します。酸化と還元の半反応を合計すると、全体的な酸化還元反応式が得られます。同様に、還元電位と酸化電位を合計すると、反応全体の電位が得られます。電位は、与えられた半反応に対して静的です。値は決して変わらないため、標準還元電位の表は電気化学者の親友です。
可能性の計算
このコンテキストでの電圧の表記は E (「e-naught」) です。 E赤 還元ポテンシャルを表し、Eox 酸化を表します。 Eセル 、または反応の全体的な可能性は、単純に Ered の合計です そしてEオックス .これをすべてまとめた例を次に示します:
還元半反応:Cl2 + 2e → 2Cl
表から、この半反応の電位は +1.36 ボルト → E赤 =1.36V.
酸化半反応:Al → アル + 3e
表から、アルミニウムの還元の電圧は -1.66 ボルトです。ただし、これはアルミニウムの酸化であり、還元ではありません。したがって、逆の電圧が使用されるため、 Eox =-E赤 =1.66V.
正味の酸化還元反応:3Cl2 + 2アル → 2AlCl3
Eセル =E赤 + Eオックス =1.36V + 1.66V =3.02V
でも待って、化学量論…
「還元半反応が正味反応で 3 倍になるのなら、なぜポテンシャルは 3 倍にならないのか?」と疑問に思う人もいるかもしれません。還元電位は、化学量論が適用されない化学の数少ない場所の 1 つです。理由は簡単です。電圧は比率であることを思い出してください。 「電荷 1 クーロンあたりに転送されるエネルギーはどれくらいですか?」アルミニウムの 3 倍の数の塩素原子を還元する必要がありますが、その変換によってもたらされる安定性 (「意志」) は、各塩素電子について同じです。したがって、塩素電子の数は、エネルギー変化に影響を与えません。
電気化学セル
電気化学セルには次の 2 種類があります。 ガルバニック そして電解 .
ガルバニ電池 長い歴史があります。その名前は、解剖されたカエルの足の筋肉に電流が加えられると痙攣することを観察したイタリアの物理学者ルイジ・ガルバーニ (1737 – 1798) に由来します。ガルバニ電池は、自発的な酸化還元反応から放出されるエネルギーを使用して電流を生成します。ガルバニ電池のもう 1 つの一般的な名前は、ボルタ電池です。 、ガルバニ (ボルタ) セルを発明した別のイタリアの物理学者、アレッサンドロ ボルタ (1745 – 1827) にちなんで名付けられました。
一方、電解セルは電流を使用して、通常は非自発的な酸化還元反応を駆動します。電解セルの典型的な例は、水に電流を流して、次の反応によって水を水素ガスと酸素ガスに分解することです:
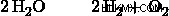
ガルバニ電池と電解電池の主な類似点は、どちらも陽極と陰極の 2 つの電極を使用し、電解液を含むことです。この電解質溶液は、セル全体の電荷を中性に保ちながら、溶液の内外へのイオンの移動を可能にします。
ガルバニ電池と電解セルの主な違いは、仕事の方向です。ガルバニ電池は自発的な化学反応を使用可能な仕事に変えますが、電解電池は仕事を使って非自発的な反応を引き起こします。

酸化はアノードで発生し、還元はカソードで発生します。これを覚えやすい記憶法は「The red cat and an ox」です。ここで、「red cat」は還元 - 陰極を意味し、「an ox」は陽極 - 酸化を意味します。
ガルバニ電池
ガルバニ電池は、電流 (電子の流れ) を生成する制御された特定の方法で酸化還元反応を促進するセットアップです。ボルタ電池、電気化学電池、およびバッテリーはすべて、ガルバニ電池の異なる名前です。以下は、すべての重要な機能を示す典型的なガルバニ電池です。
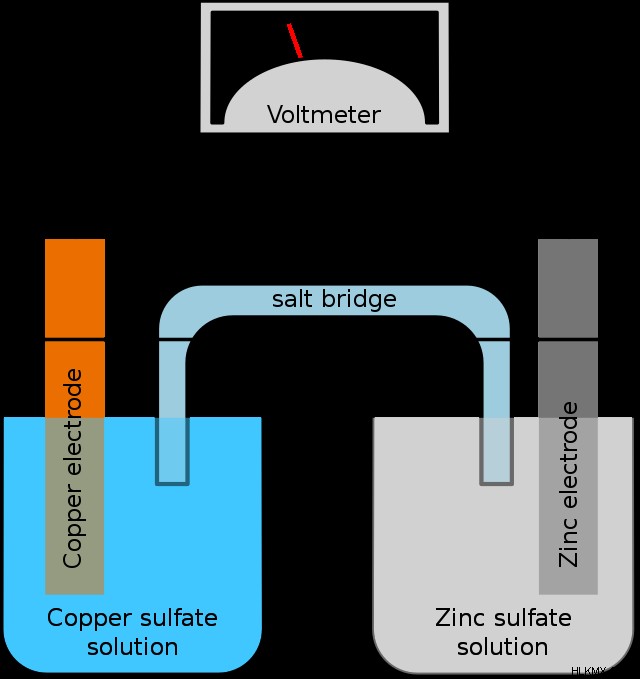
すべてのガルバニ電池には以下が含まれている必要があります:
- 電子が失われる酸化半電池
- 電子が受け入れられる還元半電池
- 2 つのセルを接続するワイヤ。多くの場合、セルの電位を測定する電圧計が含まれています
- 塩橋または電荷バランスを維持するその他の方法
これらの各機能と、それらが必要な理由を具体的に見ていきましょう。
酸化ハーフセル
酸化ハーフセルは、電子が発生する場所です。これは、電極と溶液の 2 つの主要部分で構成されています。酸化セルの電極はアノードと呼ばれます .この例では、陽極は亜鉛です。反応が起こると、電子が陽極の亜鉛金属を離れ、亜鉛イオンに変換されます。次に、これらのイオンが溶液に入ります。この場合は硫酸亜鉛です。対イオンは、アノード金属イオンと可溶である限り、問題ではありません。ただし、溶液の陽イオンは、陽極の金属と一致する必要があります。反応中、電子はアノードを出て、ワイヤーを通って還元半電池に移動し、溶液中の金属イオンの濃度を高め、アノードを侵食します。
ワイヤー
これはセットアップの最も単純な部分です。ワイヤは、電子が 2 つの半電池間を移動できるようにします。多くの場合、電位を測定する電圧計と呼ばれるデバイスに接続します。電圧計は、反応の進行状況を監視するのに役立ちますが、必須ではありません。導体はワイヤである必要はありませんが、ワイヤは、これらのタイプのセットアップでセルを接続する最も一般的な方法です.
リダクション ハーフセル
還元ハーフセルは、アノードから解放された電子の宛先です。還元ハーフセルの金属電極は、カソードと呼ばれます .電子が陰極を下って移動すると、イオン溶液に接触します。次に、溶液中の陽イオンが還元されて金属になり、カソードの表面に沈着します。シンプルなガルバニ電池では、陽イオンは陰極と一致します。 この例では、陰極に銅が使用されているため、溶液中の陽イオンは銅です。繰り返しますが、対極は重要ではありません。反応が進行するにつれて、陽イオンの濃度が下がり、陰極の質量が増加します。
塩橋
反応が進行するにつれて、電子は陽極を離れ、陰極に移動します。酸化半電池では金属イオンからの正電荷が増加し、陰極半電池では減少します。ほとんどの場合、電荷の蓄積は反応を好ましくないものにするため、これは問題です。塩橋はこの問題を取り除きます。一般に、KCl、NaNO3 などの単純なスペクテーター イオン塩 などは、良い塩橋を作ります。塩橋はこれらの化合物で飽和しており、2 つの半電池の電荷のバランスを取ります。図示の例では、塩は硫酸カリウムを含んでいてもよい。反応が進行するにつれて、カリウムイオンが還元半電池に入り、失われた銅イオンを置き換えます。同様に、硫酸イオンは酸化半電池に入り、溶液に入る亜鉛イオンのバランスをとります。 電荷を仲介する塩橋がなければ、ガルバニ電池は機能しません .
練習問題
化学者は、以下の反応を仲介するためにガルバニ電池をセットアップします:
Cr + 3Ag → Cr + 3Ag
それらは、ナトリウムイオンを使用して正電荷を媒介し、硝酸塩をすべての対イオンとして使用します。セルの各部分に適切な名前と化学種のラベルを付け、標準条件下での反応に関連する電圧をリストします。
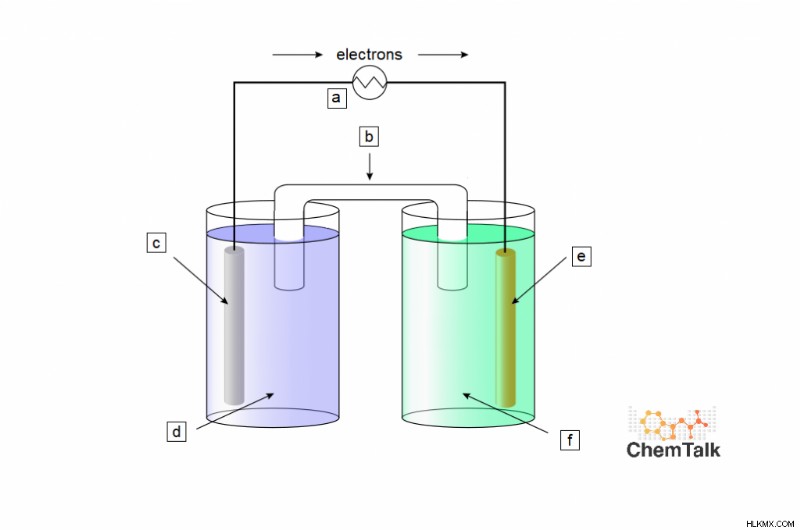
答え:
a:電圧計
b:NaNO3 塩橋
c:Cr陽極
d:Cr(NO3 )3 ソリューション
e:Agカソード
f:AgNO3 ソリューション
電圧:1.54V
ガルバニ電池の電位の測定
下の写真の古典的な Cu-Zn ガルバニ電池 (ボルタ電池) を考えてみましょう
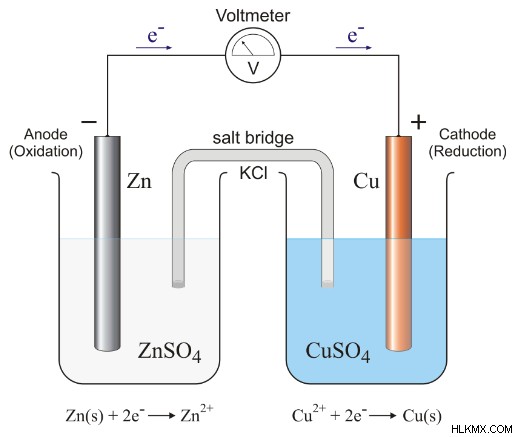
画像からわかるように、2 つの電極があります。それらの1つは亜鉛で、もう1つは銅です。前の例から、亜鉛が陽極で銅が陰極であることがわかりました。しかし、どうすればわかりますか?どちらの電極が陽極でどちらが陰極かを判断するには、2 つの半反応を考慮する必要があります。半反応は、種が酸化または還元されることで発生する正味の反応であり、電子の流れを示します。 Cu-Zn セルの 2 つの半反応を見てみましょう:

このような 2 つの半反応が与えられると、通常、還元力の高い種が還元されます。このため、Cu-Zn セルでは、銅が還元され、亜鉛が酸化されることがわかります。次に、酸化反応を示すために、亜鉛の半反応を反転する必要があります:
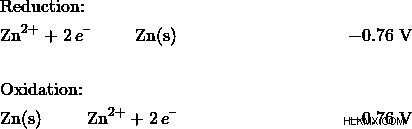
化学式をひっくり返しましたが、標準の還元電位は負のままであることに注意してください。
銅の還元の半反応と亜鉛の酸化の半反応から、これらを足し合わせて電子が適切に加算されるようにすることで、全体的な正味のレドックス反応を作成できます。
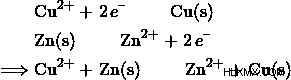
次に、方程式を使用できます 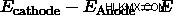 セルの全体的なポテンシャルを決定します。 Cu-Zn セルのポテンシャルは次のとおりです。
セルの全体的なポテンシャルを決定します。 Cu-Zn セルのポテンシャルは次のとおりです。
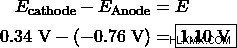
還元は陰極で、酸化は陽極で起こることを思い出してください。細胞電位の計算について詳しくは、こちらをご覧ください。
セル図
セル図を理解するのはとても簡単です。セル図の概念は、1 本の垂直線で表記される相境界と二重の垂直線で表記される塩橋を簡単に示す、より便利な線表記を提供することです。

この Cu-Zn セルの規則に従うと、次のセル図が表示されます。
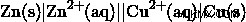
さらに読む
電気化学セルの亜鉛アノードについては、こちらをご覧ください!
ポテト電池から独自のガルバニ電池を構築
非標準条件での計算には、ネルンストの式を使用してください!