コア コンセプト
このチュートリアルでは、3 つの共同プロパティについて学習します。 :蒸気圧低下、沸点上昇、凝固点降下!また、内容を理解するのに役立つ背景情報も学びます。
他の記事で取り上げるトピック
- 物理的特性と化学的特性
- 状態
- 固体、液体、気体の性質
- 相図
Colligative プロパティに関連する概念
このトピックについて読む前に、チュートリアルを完全に理解するために、まずこのセクションを読んで理解してください!
ラウルの法則
François-Marie Raoult は、Fournes で生まれたフランスの化学者で、「Raoult の法則」を作成しました。この法則は、凝固点の降下と溶液の蒸気圧に焦点を当てています。
P(解決策) =χ (溶剤) × Pº(溶媒)
P(解決策) – 溶液の蒸気圧
χ (溶剤) – 溶媒のモル分率
Pº(溶媒) – 純溶媒の蒸気圧
ヘンリー の法則
ウィリアム・ヘンリーはマンチェスター生まれの英国の化学者で、「ヘンリーの法則」を提唱しました。この法則によれば、液体中の溶存気体の量は、液体上の分圧に比例します。この法則の例外は、ガスと溶液が互いに化学反応を起こす場合です。このため、ヘンリーの法則は「限定法則」としても知られています。
C =k × P(ガス)
C - 溶存ガスの濃度
k – ヘンリーの法則の定数
P(ガス) – ガスの分圧
モル濃度とモル濃度
- モル濃度 (M): 溶液のモル濃度。式:M =(溶質のモル数)/(溶液のリットル)
- モラリティ (m): 溶媒 1 キログラムに対する物質のモル比。式:m =(溶質のモル数)/(溶媒の kg)
溶解度
溶解度は、物質 (固体、液体、または気体) が溶媒に完全に溶解する能力です。溶解度に影響を与える多くの物理的および化学的要因があります。
たとえば、pH と溶解度は反比例の関係にあります。物質のpHが低下すると、溶解度が増加します。さらに、サイズと溶解度には直接的な関係があります。粒子が小さいほど、溶媒にさらされる表面積が大きくなるため、物質はより速く溶解します。次に、溶媒と溶質の両方の構造が、それらがどのように相互作用するかに影響を与える可能性があります。それらは、互いに混ざり合って反発しないように、疎水性などの同じ構造特性を持っている必要があります。また、温度は溶質の構造に応じて異なる効果をもたらします。固体の場合、温度が高いほど速く溶解します。ただし、気体の場合は、温度が低く、圧力が高いほど、溶解が速くなります。
共同プロパティとは
「Colligative」はラテン語の「colligatus」に由来します。これは、結合することを意味します。
これらの特性には、物質の濃度によって影響を受ける物理的な変化があります。言い換えれば、それらは溶質分子またはイオンのモル濃度またはモル濃度に依存しています。集合特性は、溶解した粒子の数のみに依存し、粒子の一意のアイデンティティには依存しません。
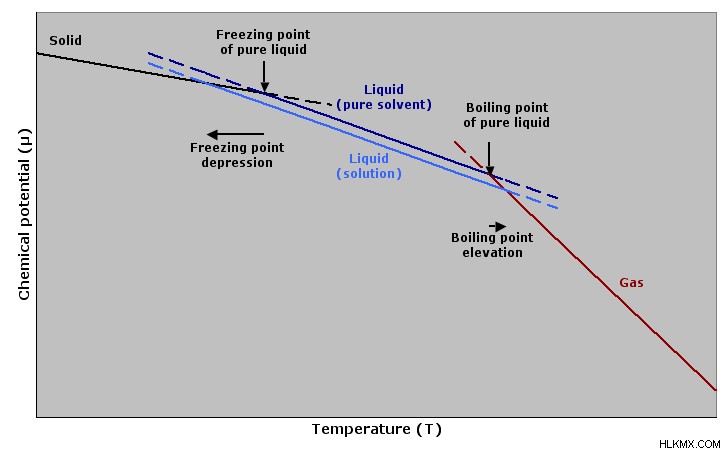
集合特性は、以下のグラフ全体で見ることができる複数のセクションに分けることができます:蒸気圧の低下、沸点の上昇、および凝固点の低下。それぞれについて詳しく見ていきましょう!
蒸気圧の低下
イオン性化合物を溶媒に加えると解離します。これが起こると、溶液の沸点が上がり、凝固点が下がります。砂糖のような物質の場合、解離しませんが、それでも沸点は上がり、凝固点は下がります。
P解決策 =χ溶媒 × P°溶剤
沸点上昇
沸点の上昇は、蒸気圧の低下に直接関係しています。すべての溶液のすべての溶質に存在します。別の化合物である不揮発性溶質が純粋な溶質である溶液に加えられると、沸点が上昇します。このとき、物質の液相と気相はエネルギー的に等価です。
ΔTb =私 × K
ΔTb =沸点の変化
私 =フォントホッフ係数
K
m =モル濃度
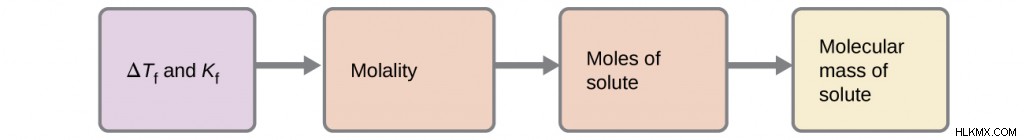
凝固点降下
この特性では、液体溶媒と固体溶媒が平衡状態にあります。ただし、これが発生する前に、凍結が発生するように温度を下げる必要があります。この特性の例はアイスクリームです。砂糖が万能溶媒である水に溶解すると、凝固点が低下し、水の修飾により結晶化が妨げられるためです。砂糖の粒子が溶媒の引力を妨げています。
ΔTF =K
ΔTF =凝固点の変化
K
m=モル濃度

さらに読む
- 化学反応とは
- 平衡定数とは?
- モル質量の計算
- 共通イオン効果







