この記事では、化学における結合の種類を見ていきます。化学結合とは何かを説明し、化学結合の種類を一覧表示し、化学結合の例を示します。結合は、化合物が持つ多くの化学的性質を決定するため、化学において非常に重要です。
化学結合
原子が互いに引き付け合い、結合して分子を形成するとき、各原子間の結合を化学結合と呼びます .結合は、分子、イオン、または結晶内の原子を「結合」します。結合は、外力またはエネルギーによって分解されるまで、無期限に続くことがよくあります.
化学結合は、安定した化合物を形成できるようにする 2 つ以上の原子間の引力です。化学結合の特定の性質はさまざまですが、最も一般的に知られているのは共有結合とイオン結合です。これらの結合により、原子間で十分なエネルギーが得られます。原子を保持するのは引力であり、電子が結合を形成できるようにします。
一次および二次債券
化学結合は、2 つのタイプのいずれかになります。一次結合と二次結合。一次結合には、共有結合、イオン結合、および金属結合があります。二次結合には、水素結合とファンデルワールス結合があります。これらの結合は、イオンや電子の共有を含まないため、一次結合よりも弱く、距離が長くなります。
化学結合 タイプ
化学における結合の種類は何ですか?共有結合、イオン結合、金属結合の 3 つの最も一般的な結合タイプを見てみましょう。
共有結合
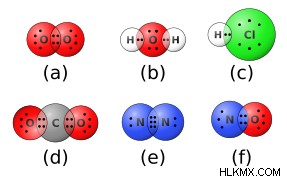
共有結合または分子結合は、一対の電子を共有する 2 つの原子間に形成される化学結合です。これらの結合を形成する元素は、一般に非金属です。 O2 のような化合物における酸素、水素、窒素の例 と H2 O)。共有結合の決定的な特徴は、電子密度が結合の中央で高いことです。これは、電子が両端よりも 2 つの原子の間にある可能性が高いことを意味します。化学者は、分子軌道理論と呼ばれるモデルを使用して、共有結合が形成される方法を記述および予測することがあります。
複数の絆
共有結合は、単結合または複数結合のいずれかです。単結合では、1 対の価電子のみが 2 つの原子間で共有されています。ただし、原子は複数の電子対を共有し、いわゆる多重結合を形成することがあります。多重結合の一般的なタイプは二重結合と三重結合であり、より高次の結合は遷移金属の特定の特殊な化合物でのみ形成されます。多重結合に最もよく関与する元素は、炭素、窒素、酸素、リン、および硫黄です。
絆の極性
共有化学結合は、極性または非極性のいずれかです。極性共有結合は電子を不均等に共有します。これは、分布が不均衡であり、1 つの原子に部分的な負電荷が残り、もう 1 つの原子に部分的な正電荷が残ることを意味します。非極性の共有結合は、電子を両方の原子間で均等に共有するため、バランスの取れた分布が得られ、同じ元素の 2 つの原子間でのみ真に形成されます。ただし、化学者は、原子間の電気陰性度の違いを使用して、「ほぼ」非極性の共有結合と極性の共有結合を区別することがあります。電気陰性度の差が約 0.4 単位未満の場合、結合は一般に無極性と見なされます。差が 0.4 を超える場合、結合はこの基準によって極性です。 1.8 単位以上の差があると、結合はもはや共有結合ではなくなり、イオン性 になります。 (下記参照)。
イオン結合
このタイプの化学結合には、ある原子から別の原子へ、通常は金属から非金属への電子の移動が含まれます (例には、NaCl と Li2 が含まれます)。 O).
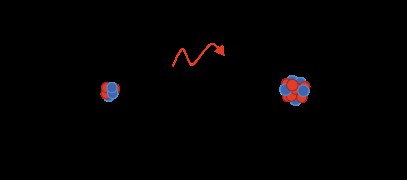
- イオン性化合物は、電子が共有されるのではなく、より電気陰性度の高い原子によって「盗まれる」ため、完全な正電荷と負電荷を持ちます。
- 電子を失った原子は正電荷を持ち、電子を獲得した原子は負電荷を持ちます。
金属結合
金属結合は、金属中の原子間の化学結合です。自由に移動する電子の海と同様に、これらの結合は金属内のすべての原子を一度に接続します (原子が分子の特定の部分で電子の個別のペアを共有する共有結合とは対照的です)。これらの化学結合は、光沢、電気伝導性、熱伝導性など、バルク金属の多くの特性に関与しています。
ケミカル ボンド 他の記事のトピック
- イオン結合と共有結合
- 水素結合とは
- 分子間力
- イオン双極子力の説明
- 絆形成エネルギー
化学結合とオクテット規則
原子には、原子核から最も離れた価電子と呼ばれる電子があり、化学結合に関与しています。これらの電子は、安定性を達成するために、原子が外殻に 8 つの電子を持たなければならないというオクテット規則を達成するために、共有または転送する必要があります。ただし、この規則は炭素や窒素などの主族元素にのみ適用されます。
ホウ素はオクテット規則の注目すべき例外です。多くの場合、電子が 6 つしかないことを好み、BF3 やホウ酸 (H3BO3) などの化合物を形成します。周期表の 3 行目以降にある元素は、拡張オクテットを持つことができます。これは、原子価殻に 8 個を超える電子があることを意味します。リン、硫黄、ヨウ素は、拡張オクテットを持つことができる一般的な元素です。