複合気体法則は、圧力、温度、および体積の間の関係を定義します。これは、チャールズの法則、ボイルの法則、ゲイ・リュサックの法則など、他の 3 つの気体法則の名前に由来しています。以下では、法則の方程式、それがどのように導き出されるかを説明し、解決策を含む練習問題を提供します。
混合ガス法
複合気体法則は、他のすべてが一定に保たれている場合 (主に気体のモル n) に圧力、温度、および体積を関連付けます。複合気体法則の方程式の最も一般的な形式は次のとおりです。
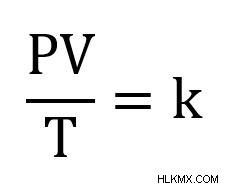
P はガスの圧力です。 T はガスの温度です。 V は気体の体積です。 k は定数です。 k の正確な値は、ガスのモルに依存します。
複合気体法則は、2 つの異なる時点として記述されることもよくあります。つまり:

両方の k は同じ値であるため、互いに等しく設定できます。以下の式が得られます:

結合気体法則の関係は、気体が理想気体として機能する限り機能します。一般に、これは温度が高く圧力が低い場合に当てはまります。気体が理想気体である理由については、記事「理想気体の法則」で詳しく知ることができます。
複合ガス法の導出
複合気体法則は、シャルルの法則、ボイルの法則、およびゲイ・リュサックの法則を組み合わせて導出されます。
シャルルの法則は、体積と温度の関係を示します。つまり、V/T =k です。ボイルの法則によると、P*V =k です。最後に、ゲイ・リュサックの法則は、P*T =k であることを示しています。
これらすべての関係が 1 つの方程式に結合されると、結合気体法則が得られます。
結合気体の法則が拡張され、気体のモル数 (n) が一定に保たれない場合、理想気体の法則が得られます。また、理想気体の法則から逆算して、さまざまな変数を一定に保つことで他の気体の法則を取得することもできます。複合気体法則の場合、気体のモル数 (n) を一定に保つことでそれが起こります。
問題例 1
容積 2L、圧力 760mmHg の容器に 303K のガスのサンプルがあるとします。サンプルを 340 K の温度に移動すると、体積が 2.1 L にわずかに増加します。現在のサンプルの圧力は?
解決策:
ここでは、2 つの異なる状態を見ています。元の状態を下付き文字 1 で、2 番目の状態を下付き文字 2 で表します。まず、既知の変数を書き出します。
V1 =2L
T1 =303K
P1 =760mmHg
V2 =2.1L
T2 =340K
P2 =?
P2 を除くすべての変数を知っています .また、前後の状態を見ていることもわかるので、次の式を使用します。

次に、P2 を解くように方程式を再配置します。 .まず、各辺に T2 を掛けます .
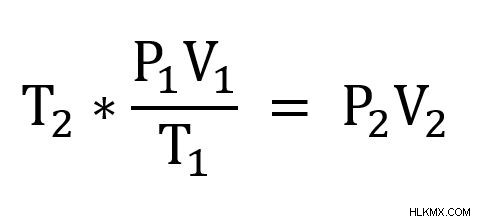
次に、各辺を V2 で割ります .
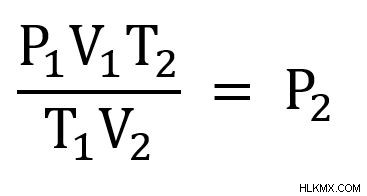
次に、既知の変数をプラグインして解決します。
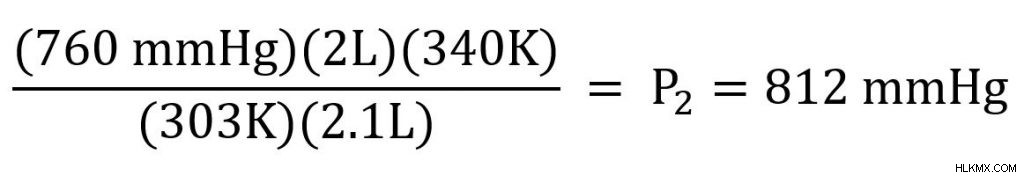
最終的な圧力は 812 mmHg です。また、圧力の単位を除くすべての単位がキャンセルされることに注意してください。
問題例 2
620 mmHg、177 K の気体を採取します。採取時に 1.3 L の体積を占めます。標準の温度と圧力に移動したときの気体の体積は?
解決策:
ここでは、気体の 2 つの異なる状態、状態 1 と状態 2 を見ています。したがって、次の形式の結合気体法則を使用します。
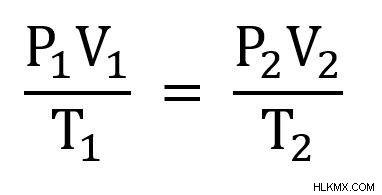
最初のステップは、既知の変数を決定することです。圧力、温度、体積は元の状態 1 に対して与えられます。圧力と温度は状態 2 に対して与えられます。これは、標準温度と圧力が 760 mmHg と 273 K として定義されているためです。不明な唯一の変数はボリューム 2 であり、これを解決する必要があります。
T1 =177K
P1 =620mmHg
V1 =1.3L
T2 =273K
P2 =760mmHg
V2 =?
計算を簡単にするために、式を並べ替えて V2 を解いてみましょう 値を差し込む前に。これを行うには、両辺に T2 を掛けます。 次に P2 で割ります .
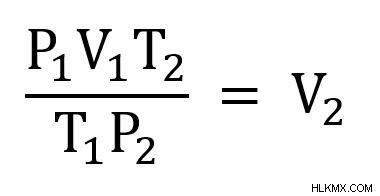
ここで、既知の値をプラグインして解決します。
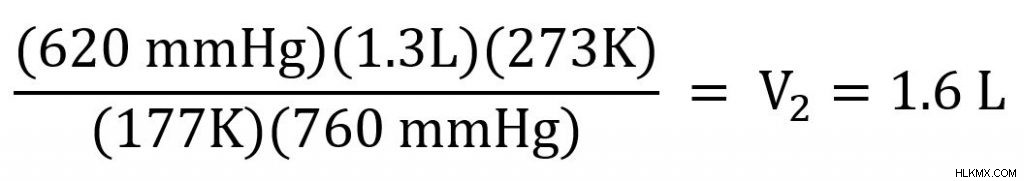
ガスの新しいボリュームは 1.6L です。そのため、ガスの温度と圧力が上昇すると、ガスの体積も増加しました。
その他のガス法
- シャルルの法則
- ボイルの法則
- ゲイ・リュサックの法則
- 理想気体の法則
- ダルトンの法則
- アボガドロの法則
- ヘンリーの法則







