主な違い – クロロホルムと塩素
塩素は、原子番号 17 の化学元素です。しかし、一般的に、塩素という用語は、塩素の二原子気体化合物である塩素ガスを指すために使用されます。塩素ガスおよびその他の塩素含有化合物は、消毒剤として、および他の製品の製造に非常に役立ちます。クロロホルムは、メタンと塩素ガスの反応によって形成される一般的な麻酔化合物です。クロロホルムと塩素の主な違いは、クロロホルムは室温で液体として存在し、重く、エーテルのような臭いと甘い味がしますが、塩素は黄緑色のガスとして存在し、チョッとした臭いがあります.
対象となる主な分野
1.クロロホルムとは
– 定義、化学的性質、製造、用途
2.塩素とは
– 定義、化学的性質、用途
3.クロロホルムと塩素の違いは何ですか
– 主な相違点の比較
重要な用語:原子番号、塩化物、塩素、クロロホルム、フリーラジカルハロゲン化、同位体、メタン、四面体、トリクロロメタン

クロロホルムとは
クロロホルムは、化学式 CHCl3 を持つ一般的な麻酔薬 (痛みを感じにくくする物質) の化学種です。 .この化合物のモル質量は 119.369 g/mol です。 トリクロロメタンとも呼ばれます クロロホルムの化学構造は、3 つの水素原子が塩素原子に置換されたメタンに似ているためです。
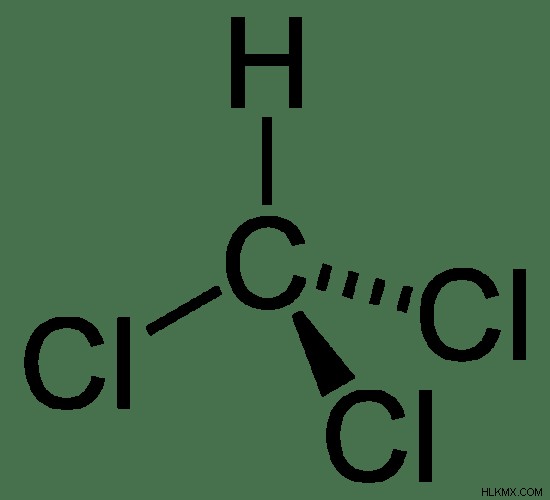
図 1:クロロホルムの化学構造
室温では、クロロホルムは揮発性の高い無色の液体として存在します。重く、エーテルのようなにおいがあり、甘い味がします。クロロホルムの融点は-63.5℃、沸点は61.15℃です。しかし、それは 450 °C で分解します。クロロホルムは水に溶けにくいが、ベンゼンなどの有機溶媒にはよく溶ける。クロロホルムは水よりも密度が高い(25℃で 1.489 g/cm )。クロロホルム分子の形状は四面体です。

図 2:クロロホルム
クロロホルムは、メタンの塩素化によって生成されます。ここでは、塩素とメタンの混合物を約400℃に加熱します。塩素化は、フリーラジカルのハロゲン化として発生します。
CH4 + Cl2 → CH3 Cl + HCl
CH3 Cl + Cl2 → CH2 Cl2 + HCl
CH2 Cl2 + Cl2 → CHCl3 + HCl
クロロホルムの最も重要な用途は、クロロホルムと HF (フッ化水素) の反応によるモノクロロジフルオロメタン (CFC-22) の生成です。油脂、ゴムなどの溶剤としても使用される。クロロホルムの水素原子を重水素同位体で置換すると、CDCl3 、NMR 分光法で使用される溶媒です。ただし、クロロホルムの最も一般的な用途は、麻酔薬としての使用です。手術や犯罪活動にも広く使われていました。ただし、手術でのクロロホルムの使用は、肝臓に損傷を与える可能性があるため、厳密に管理されています.
塩素とは
塩素は原子番号 17 の化学元素です。塩素は周期表の 17 族に属し、ハロゲン族と呼ばれ、p ブロックに属します。非金属です。塩素の電子配置は [Ne]3s3p です。軌道を完全に埋めるには、電子が 1 つ欠けています。したがって、塩素原子は非常に反応性があります。塩素は、電子配置を完成させるために、外部から 1 つの電子を獲得することによって、-1 の電荷を持つ陰イオンを形成します。しかし、一般に、塩素という名前は、塩素二原子ガス (Cl2 ).

図 3:球状の塩素ガス
室温と圧力では、塩素は黄緑色の気体として存在します。塩素ガスは、むせるような臭いがあります。塩素の同位体はほとんどありません。最も一般的な同位体は、塩素 35 と塩素 37 です。ただし、塩素-35 は安定性が高いため、これら 2 つの中で最も豊富な同位体です。塩素の最も安定な酸化状態は -1 です。塩素原子は、外部から(電子供与化学種から)電子を1つ取得することにより、電子配置を完成させて安定した電子配置を得ることができます。
塩素ガスおよびその他のほとんどの塩素含有化合物は細菌を殺すことができます。そのため、飲料水やプールの水を処理する消毒剤として使用されています。ただし、塩素ガスは主に PVC (ポリ塩化ビニル) の製造に使用されます。
Cl2 であるため、塩素ガスは酸化剤として使用できます。 塩化物イオンを形成するために還元することができます (クラニオンは塩化物イオンとして知られています)。塩素のもう 1 つの主な用途は、麻酔薬であるクロロホルムのイオン製造です。
クロロホルムと塩素の違い
定義
クロロホルム: クロロホルムは、化学式 CHCl3 を持つ一般的な麻酔化学種です。 .
塩素: 塩素は、原子番号17と記号Clを持つ化学元素です。しかし、一般的に二原子塩素は塩素とも呼ばれます。
モル質量
クロロホルム: クロロホルムのモル質量は 119.369 g/mol です。
塩素: 塩素原子の原子量は 35.453 amu.
自然
クロロホルム: クロロホルムは室温で揮発性の液体です。
塩素: 塩素は室温で二原子気体です。
物理的特性
クロロホルム: クロロホルムは重く、エーテルのようなにおいがあり、甘い味がします。
塩素: 室温と圧力では、塩素は黄緑色のガスとして存在し、むせびような臭いがします.
用途
クロロホルム: クロロホルムは、モノクロロジフルオロメタンの製造に使用され、油脂、ゴムなどの溶媒として使用されます。以前は麻酔薬として使用されていましたが、現在は使用が制限されています。
塩素: 塩素含有化合物は主に消毒剤として使用され、塩素は PVC などの化合物の製造に使用されます。
結論
クロロホルムは、メタンと塩素の間のフリーラジカルハロゲン化反応から生成されます。クロロホルムは麻酔薬として一般的に使用されていましたが、現在では肝臓への損傷のために使用が制限されています.塩素は原子番号 17 の化学元素です。室温では、二原子塩素ガスとして存在します。クロロホルムと塩素の主な違いは、クロロホルムは室温で液体として存在し、重いエーテルのようなにおいがするのに対し、塩素は黄緑色のガスとして存在し、むせつくようなにおいがすることです.
参照:
1.「塩素 – 元素情報、特性および用途 |周期表。"王立化学協会、こちらから入手可能。
2.「クロロホルム」。国立バイオテクノロジー情報センター。 PubChem 化合物データベース、米国国立医学図書館、こちらから入手可能。
3. Carey, Francis A.「クロロホルム」。ブリタニカ百科事典、ブリタニカ百科事典、2017 年 11 月 15 日、こちらから入手可能。
画像提供:
1. 「表示されたクロロホルム」Benjah-bmm27 による元の画像、Fvasconcellos によってベクトル化 – 画像:クロロホルム-2D.png (パブリック ドメイン)、コモンズ ウィキメディア経由
2. 「Danny S. によるクロロホルム – 002」Danny S . – Commons Wikimedia経由の自身の作品 (CC BY-SA 3.0)
3. W. Oelenによる「塩素球」 – (CC BY-SA 3.0) Commons Wikimedia経由