H2 SO4 酸名は硫酸です。それは 2 つの酸性プロトンを持っているため、腐食性の高いジプロトンです。言い換えれば、酸性のHプロトンに結合した硫酸分子が含まれています。この酸は、皮膚、歯、目、肺に有害なため、取り扱いには細心の注意を払う必要があります。長時間の暴露は死に至ることさえあります。多くの場合、硫酸にさらされる労働者にその有害な影響が観察されます。ただし、暴露のレベル、期間、および種類は、害の程度に大きな影響を与えます。次の記事では、硫酸の特性、構造、およびさまざまな用途について説明します。
H2 SO4 化合物名
H2 SO4 酸性が強い性質を持っています。高濃度では酸化剤および脱水剤として機能します。水に溶けると熱を発生します。酸には次の名前があります:
- 硫酸
- 硫酸
- マトリング酸
- ビトリオールの油
- 硫酸二水素
- バッテリー酸
- 浸漬酸
- 電解酸
- ビトリオール ブラウン オイル
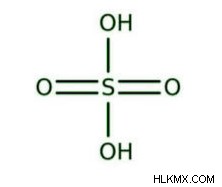
硫酸の構造
これは、2 つの酸素原子にしっかりと結合した 2 つの水素原子を含み、2 つの OH 基を形成します。 2 つの酸素原子も、二重結合を介して中央の硫黄に結合しています。酸は、四面体構造を持つ共有結合分子です。
この強酸は完全にイオン化して、次の 2 つのイオンを形成します:
- ヒドロニウムイオン (H3 O)
- 硫酸水素イオン (HSO)
硫酸のルイス構造
結合電子対と非結合電子対を示すルイス構造は次のとおりです。
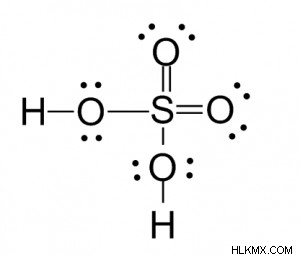
硫酸含有
- 8 個の孤立電子対または 16 個の非結合電子
- 8 つの結合電子対
硫酸の調製
コンタクト製法で作られています。反応の重要なステップは次のように要約されます:
ステップ 1 :二酸化硫黄の調製
酸素が豊富な空気中で硫黄を燃焼させると、二酸化硫黄が得られます。バランスの取れた反応は次のとおりです。
S(s) + O2 (g) → SO2 (g)
ここで、固体硫黄がガス状酸素と反応して、ガス状二酸化硫黄が生成されます。
ステップ 2:二酸化硫黄から三酸化硫黄への変換
二酸化硫黄が酸素と同じ比率で反応すると、三酸化硫黄が形成されます。反応に必要な温度は400℃~450℃です。また、1〜2気圧の圧力を維持する必要があります。五酸化バナジウムは、反応の触媒として機能します。この反応は本質的に可逆的であるため、特別な注意が必要です。
2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g)
ステップ 3:濃硫酸の調製
ガス状の三酸化硫黄は霧の形成につながるため、水に直接溶解することができないため、三酸化硫黄は濃硫酸と反応します.
したがって、三酸化硫黄が硫酸と反応すると、発煙硫酸が形成されます。次にオレウムを水に溶かして濃硫酸を生成します。
H2 SO4 + SO3 (g) → H2 S2 O7 (l)
H2 S2 O7 (l) + H2 O(l) → 2 H2 SO4
硫酸の性質
先に述べたように、硫酸は強酸性で腐食性があります。それは酸化剤および脱水剤として機能します。無色無臭です。それは水溶性で、非常に極性の高い液体です。これは、さまざまな産業で大規模に使用される最も重要な重工業用化学物質の 1 つです。
無色の油性液体で、金属や組織を腐食します。接触すると木材やその他の有機物を焦がします。ただしなかなか着火しません。重要な物理的特性の一部を以下に示します:
- 吸湿性の液体
- 色:無色からこげ茶色
- におい:無臭の液体
- 一貫性:オイリー
- 分子量:98.08
- 水素結合ドナー数:2
- 水素結合アクセプター数:4
- 沸点:337 °C
- 融点:10.31 °C
- 密度:1.841
- 蒸気密度:3.4
硫酸が関与する化学反応
硫酸はさまざまな物質と反応し、多様な生成物を生成します。いくつかの重要な化学反応を以下に示します:
加熱時の金属との反応
濃硫酸は強力な酸化剤です。金、イリジウム、プラチナ、ロジウム、タンタルを除く多くの金属を酸化できます。
- 高温の濃硫酸はアルミニウムなどの金属と反応し、H₂S、S、SO₂ に還元されます。
8 Al + 15H₂SO₄ (濃縮)→ 4Al₂ (SO₄)₃ + 12 H₂O + 3H₂S
- 銅は高温の濃硫酸と反応して、次の反応を起こします:
Cu+ 2H2 SO4 →CuSO4 +SO2 +2H2 O
- クロムのような中程度の活性の金属と反応して、次の生成物を生成します:
2Cr + 4 H2 SO4 (濃縮)→ Cr2( SO4 )3 + 4 H2 O + S
- 活性の低い金属では、硫酸は次の反応を示します:
2Bi + 6H₂SO₄ (濃)→ Bi₂(SO₄)₃ + 6H₂O + 3SO₂
- アルミニウムや鉄などの金属が冷濃硫酸と反応すると、酸化膜で覆われます。このプロセスは不動態化と呼ばれます。
- 水との反応
H2SO4 が水と混合されると、発熱プロセスが観察されます。この反応では、溶液が沸騰するほどの大量の熱が発生します。
したがって、危険を避けるためには、酸に水を加えるよりも、水に硫酸を加える方が常に良い.
反応は次のとおりです:
H2 SO4 + H2 O → H3 O + HSO
脱水剤として
酸は強力な脱水物質です。さまざまな化合物から水を押し出すため、乾燥剤としてよく使用されます。
濃硫酸が糖やブドウ糖と反応すると、脱水剤として働きます。砂糖から水分を取り除きますが、このプロセスは非常に発熱的です。
C12 H22 O11 + H2 SO4 → 12C + 11H2 O + (酸と水の混合物)
希硫酸の反応
一般的な反応は、亜鉛に硫酸を作用させて水素を得る反応です。亜鉛顆粒を希硫酸に加えると、金属が溶解する間に水素ガスが発生します。バランスの取れた反応は次のように与えられます:
Zn + H₂SO₄ → ZnSO₄ + H₂
希硫酸は、反応度列の水素の左側にある金属と反応し、次のように反応が進みます。
Ме + H₂SO₄(希釈) → 塩 + H₂↑
硫酸とバリウムの反応
定性分析では、硫酸とその塩をバリウムイオンと反応させます。
H₂SO₄ + BaCl₂ → BaSO₄ + 2HCl
ZnSO₄ + BaCl₂ → BaSO₄ + ZnCl₂
硫酸の使用
硫酸は多くの産業で使用されています。最も一般的な用途は次のとおりです。
- 肥料の製造において
- 廃水の処理
- 鉛蓄電池の場合
- 肥料の製造に使用されます。
- 鉄鋼および製鉄で広く使用されています。
- ナイロン製造の触媒として
- 石油精製において
- リン酸生産用
- 鉄鋼のサビを落とす洗浄剤として
- 電解質として
- 硫酸アンモニウムを作るのに便利です。
- 蓄電池内
- 他の化学物質の製造において
- 爆薬と接着剤の製造用
- 金属を治す
- 鉛ベースの自動車用バッテリー
硫酸に関連するリスク
腐食性の酸が直接接触すると、皮膚や組織に深刻な損傷を与える可能性があります。さらに、硫酸蒸気も吸入すると有害です。
曝露に対する反応は次のとおりです:
- 人間の皮膚を刺激して火傷します。
- 目に刺激を与え、失明に至ることさえあります。
- 肺に液体がたまる可能性があります。この状態は肺水腫と呼ばれます。
- 硫酸にさらされると、頭痛、嘔吐、吐き気を引き起こすこともあります。
- 誤って飲むと歯が腐食します。
- 皮膚との接触は壊死につながる可能性があります。
- 上気道を非常に刺激します。
- 硫酸は深刻な肺障害や緊急事態を引き起こす可能性があります。
- 死に至ることさえあります。
硫酸にさらされる労働者の例には、
- 石油や石炭を燃やしている地域で働く屋外労働者
- バッテリーの開発またはメンテナンスに参加する整備士
- 便器洗浄剤と混合水を使用する配管工。
- 出版、写真、または印刷所で働いている人
- 消防士
- 硫酸ミストにさらされた鉄鋼労働者
結論
硫酸は有害でありながら有用な化学物質であり、化学産業では価値が高い.それは人間に害を及ぼすため、医療機関は、雇用主が労働者の曝露を制御、防止、または削減することを推奨しています。
よくある質問
1.硫酸はどのように中和しますか?
A. 硫酸は単純な中和反応が最適です。重曹をこぼれた酸に注ぐと、酸が中和されて塩と水になります。このプロセスは、酢酸などの軽酸や、硫酸などの有毒な強酸で機能します。
2.硫酸はイオンですか?
A. 硫酸は共有結合を含んでいるため、共有化合物です。ただし、イオン化して溶液中でヒドロニウムイオンと硫酸イオンを生成します。
3.硫酸を水で中和することは可能ですか?
A. いいえ、硫酸は水では中和できません。ただし、酸を水で希釈することはできます。水に数滴の酸を慎重に加えます。プロセスは発熱するため、混合物をかき混ぜるのが最善です。
硫酸を中和するには、水酸化ナトリウムなどの強塩基が必要です。
4.硫酸はどの反応で触媒として使用されますか?
A. 硫酸は、いくつかの反応に直接関与しています。次の反応では、触媒として硫酸が使用されます。
- ナイロンの製造工程
- HCl の製造のためのマンハイム プロセス
- 石油精製