コア コンセプト - 衝突理論
衝突理論に関するこのチュートリアルでは、衝突が成功する理由について学びます。また、衝突と反応率を高める方法と、衝突理論の重要性についても学びます。
他の記事で取り上げるトピック
運動分子理論の理解
反応速度と速度法則の決定方法
触媒と活性化エネルギー
プレッシャー
定常状態近似
衝突理論の語彙
カタリスト – 反応に消費されず、活性化エネルギーを減少させ、反応を速める物質。触媒の詳細については、こちらをご覧ください。
運動エネルギー – 運動による物体のエネルギー
活性化エネルギー – 反応物が反応するために必要な最小エネルギー
キネティクス – 反応の速度と速さの研究
衝突理論の紹介
衝突理論は、反応が起こるためには、反応物が適切に衝突しなければならないと述べています。反応速度は、衝突の頻度に等しくなります。原子衝突の頻度はガスでのみ正確に計算できるため、衝突理論はガスに限定されます。 Max Trautz は 1916 年に衝突理論を提案し、William Lewis は 1918 年に独立して提案しました。
効果的な衝突
効果的な衝突とは、化学反応を引き起こす衝突です。効果的な衝突率が高いほど、反応速度が速くなります。
衝突が効果的に化学変化を起こすには、十分なエネルギーと正しい向きが必要です。衝突を成功させるには、原子間の結合を破壊して再配置するのに十分な運動エネルギーが必要です。そうしないと、ボールのように互いに跳ね返ります。 2 つの反応物間の衝突の頻度は、反応物の濃度に比例します。たとえば、1 つの反応物の濃度を 2 倍にすると、衝突回数が 2 倍になります。室温では、1 立方センチメートルの気体が 1 秒間に 10 回衝突します。ただし、これらの衝突がすべて成功した場合、すべての反応は 1 秒以内に完了します。
衝突の方向は、反応中の分子が複雑になるほど重要になります。たとえば、N2 間の反応では OとNO、N2の酸素 反応が起こるには、OがNOの窒素にぶつかる必要があります。分子が複雑になればなるほど、衝突の数は少なくなり、反応に適した方向になります。
要約すると、衝突が効果的に反応を引き起こすには:
- 分子は衝突する必要があります
- 衝突には十分なエネルギー (活性化エネルギー) が必要です
- 分子は適切な向きでなければなりません
衝突の増加
衝突の数を増やして反応速度を上げるために操作できる要因はたくさんあります。これらの要因の一部を以下にリストして説明します。
反応物の濃度
反応物の濃度が高いほど、衝突できる分子が多くなります。

気温
温度が高いほど、反応物はより多くの運動エネルギーを持ちます。運動エネルギーが大きくなると、分子はより速く動きます。したがって、反応物はより頻繁に、より多くのエネルギーで衝突します。
プレッシャー
圧力を上げると、反応物の分子間のスペースが減少します。スペースが少ないと、分子はより頻繁に衝突します。
状態
気体は液体よりも速く、液体は固体よりも速くなります。たとえば、人が部屋の中をランダムな方向に走っている場合、歩いている場合よりも衝突する可能性が高くなります.
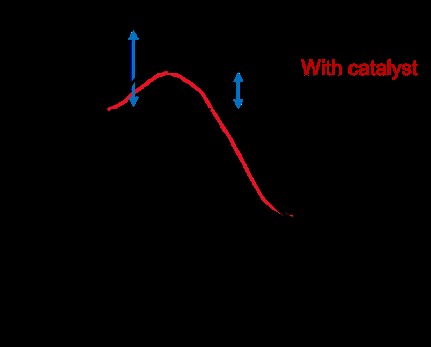
触媒
触媒は反応を加速し、分子が衝突するメカニズムを変化させます。それらは反応によって消費されず、変化しません。触媒は、反応に必要な活性化エネルギーを下げることで反応を加速します。
衝突理論が重要な理由
衝突理論は、反応速度を上げる方法を説明しています。衝突を増加させるすべての要因を分析することにより、数式を使用してレート方程式を形成します。反応率は、衝突を増加させる要因に依存します。必要な製品を効果的に作成するには、反応速度を決定して操作できることが重要です。