コア コンセプト
この記事では、最も重要な生体分子の 1 つである酵素の機能、力学、および種類について学びます。
酵素とは?
酵素は、細胞内の化学反応を触媒する役割を担う生体分子のクラスです。酵素は、細胞の最も重要な生化学的変化の多くを可能にするため、生命を可能にします.実際、酵素がなければ、細胞呼吸、光合成、タンパク質合成などの重要なプロセスは発生しません。実際、酵素の有用性により、分子クローニングや PCR などの研究において重要なプロセスで酵素を使用することができます。
酵素の大部分はタンパク質です。これらの酵素は、すべてのタンパク質と同様に、ペプチド結合によって結合されたアミノ酸でできています。すべてのタンパク質と同様に、酵素は極端な条件下で変性することがあります。しかし、生化学者が「リボザイム」と呼ぶ、代わりにリボ核酸 (RNA) でできている多くの酵素が存在します。興味深いことに、多くの酵素は主にアミノ酸でできていますが、酵素の機能で重要な役割を果たす金属カチオンまたは有機材料から作られた追加の結合成分を持っている場合があります。生化学者は、有機非タンパク質構造成分を「補欠分子族」と呼んでいます。
補欠分子族とは別に、酵素は、「補基質」と呼ばれる主要な反応物以外の反応に参加する分子を必要とする場合もあります。まとめて、生化学者は「補因子」という用語を使用して、酵素によって使用される補助基質、補欠分子族、および金属カチオンを包含します。
酵素は、グループとして広範な構造上の多様性を持ち、生化学者はさまざまな形やサイズの酵素を観察してきました。この多様性は、生命に必要な膨大な量の化学反応により、酵素が果たす幅広い機能を反映しています。
酵素の役割
前述のように、酵素は反応触媒の重要な機能を果たします。言い換えれば、酵素はゆっくりとした律速反応を容易にし、反応連鎖全体をスピードアップします。酵素がこの目的を果たす方法は、その構造に直接関係しています。
アクティブ サイト
すべての酵素には、目的の反応物が結合する活性部位と呼ばれる重要な構造があります。生物は、1 つの特定の反応を実行するために酵素を構築する傾向があります。つまり、酵素の活性部位は、その反応の反応物にのみ結合する必要があり、他には何も必要ありません。このため、酵素の活性部位は一般に高い基質特異性を持っています。つまり、その反応の反応物だけが活性部位に化学的に結合できることを意味します。 「基質」は、酵素に結合する目的の分子を記述するために生化学者が使用する専門用語です。
さらに、酵素の基質特異性はその活性部位の化学的性質に由来するため、酵素の基質は特定の方向に結合する必要があります。基質の化学基は、酵素に結合するために特定の方法で活性部位の化学基と相互作用する必要があります。
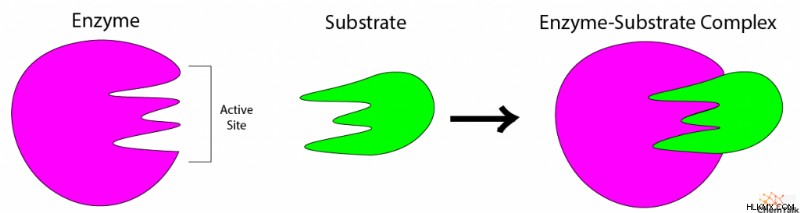
活性部位は特定の方向の基質にのみ結合するため、酵素はキラル基質の特定の立体異性体に対して特異性を持つことができます。
基質が活性部位を満たすと、酵素のコンフォメーション、またはその生化学的構造が変化します。これにより基質がシフトし、目的の反応が容易に起こるようになります。
一般に、酵素触媒反応には、化学結合の切断と形成の両方が含まれます。これを行うために、酵素の立体構造の変化には、分子の一部を分離して結合を切断し、他の構造を結合して結合を形成する酵素構造が関与する傾向があります。
遷移状態
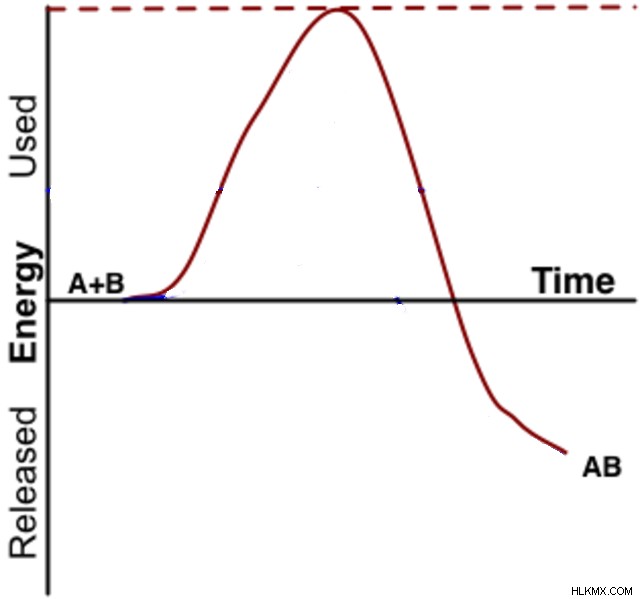
前述のように、酵素は反応を最大限に容易にするために基質を操作することによって反応をスピードアップします。化学者は、反応の「遷移状態」を見ることでこの現象を理解しています。ただし、遷移状態は、分離可能な分子ではなく、生成物と反応物の間に必要な段階を表すもので、一瞬だけ存在します。
すべての反応には遷移状態があり、この状態の化学反応が反応速度を決定します。寿命が短いため、遷移状態はその生成物や反応物よりもはるかに高いエネルギーを持ち、安定性がはるかに低くなる傾向があります。したがって、反応が反応物から生成物へのエネルギーの正味の放出を伴う場合でも、反応物は反応を開始するためにいくらかのエネルギーを吸収する必要があります。化学者は通常、エネルギー図を使用してこれを描写します。この図では、反応物は、生成物を形成するためにエネルギーを下げる前に、遷移状態に到達するためにエネルギーの丘を登る必要があります。
ここで酵素の出番です。酵素の活性部位の構造は、遷移状態を安定化するように特別に設計されています。多くの場合、酵素は活性部位の相補的な基で最も反応性が高く不安定な基を保護することでこれを行います。
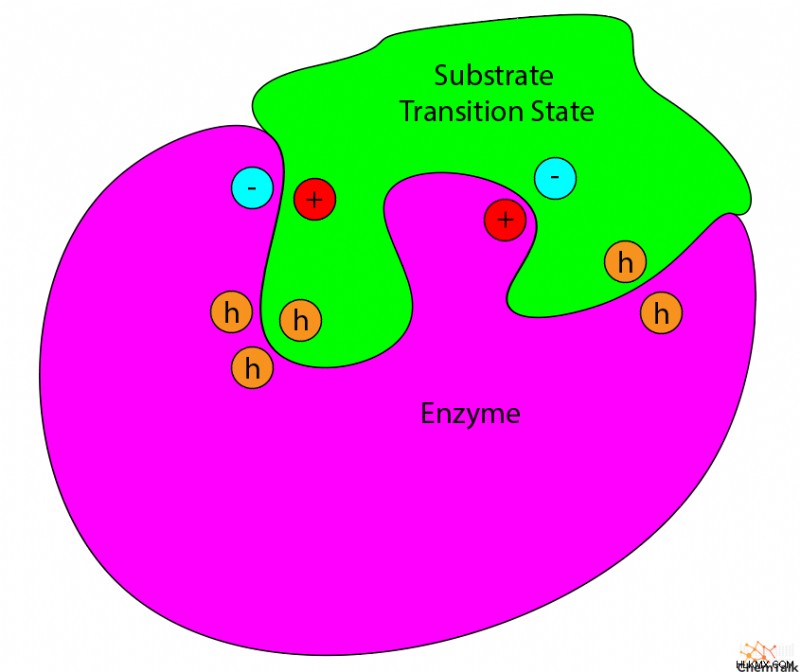
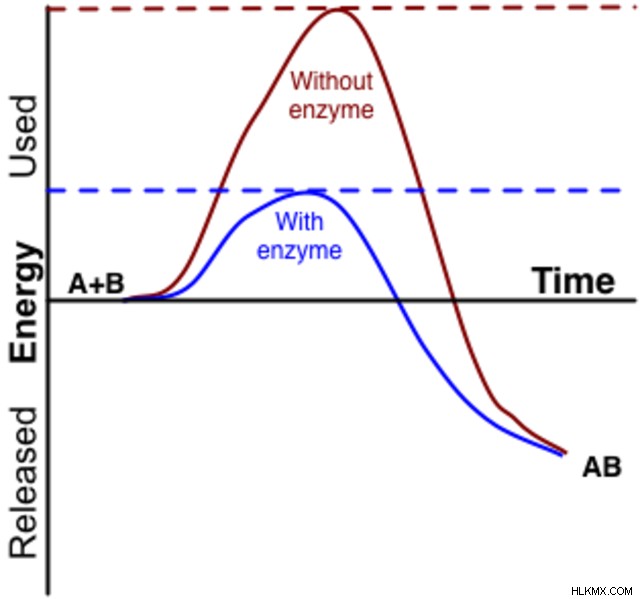
遷移状態を安定させることにより、酵素は全体的なエネルギーを全体的に下げます。これにより、反応のエネルギー障壁が低下し、より速い速度で進行できるようになります。前述のように、この触媒作用により、生命が存在するのに十分な速さで重要な生化学反応が起こることができます。定常状態近似は、ほとんどの酵素触媒反応に適用されます。
酵素の例は?
酵素は、生物の中で触媒する多種多様な生化学反応のために、タンパク質の多様なグループを表しています。生化学者は、接尾辞「-ase」を使用して酵素を表します。最も重要な酵素の多くは、次の 6 つの広範なグループのいずれかに分類されます:
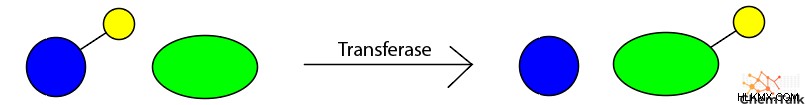
- 転移 、分子間の化学基の移動を伴う反応を触媒します。
- 例:アセチルトランスフェラーゼ、メチルトランスフェラーゼ、ペプチジルトランスフェラーゼ
- 加水分解酵素 、加水分解反応を触媒し、水を使用して大きなポリマー分子を分解します.
- 例:アミラーゼ、リパーゼ、プロテアーゼ
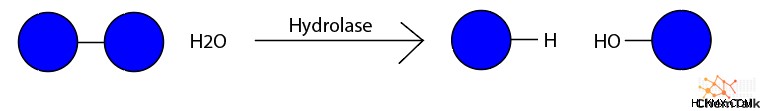
- 酸化還元酵素 、酸化還元反応を触媒します。
- 例:カタラーゼ、NADPH オキシダーゼ
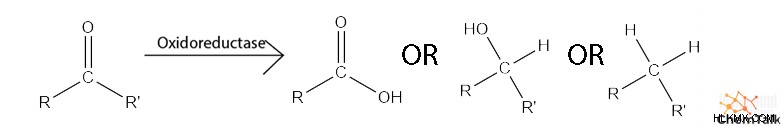
- リアーゼ 、炭素-炭素二重結合を形成する脱離反応を触媒します。
- 例:アルドラーゼ、デハロゲナーゼ
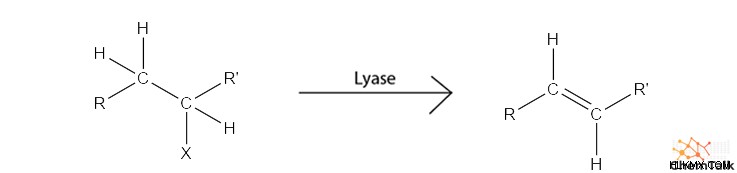
- リガーゼ 、ATP を使用して結合形成反応を触媒します。
- 例:DNA リガーゼ、アミノアシル tRNA 合成酵素、ユビキチン リガーゼ

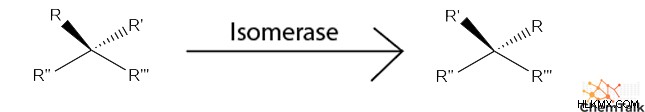
- イソメラーゼ 、分子を異なる異性体に変換する反応を触媒します。
- 例:ラセマーゼ、イソメラーゼ