主な違い – 分子間水素結合と分子内水素結合
分子は、同じ元素または異なる元素の原子が集まって電子を共有し、共有結合を形成するときに形成されます。共有結合分子を一緒に保つ引力には 2 種類あります。これらは分子間力と分子内力と呼ばれます。分子間力は 2 つの分子間で発生する引力ですが、分子内力は分子自体の内部で発生します。水素結合は、水素原子が電気陰性度の高い原子と電子を共有することによって分子内に形成される特殊なタイプの結合です。水素結合は、分子間力と分子内力の両方として発生する可能性があります。分子間水素結合と分子内水素結合の主な違いは、分子間結合は 2 つの隣接分子間で発生するのに対し、分子内水素結合は分子自体の内部で発生することです。
これら 2 つの力がどのように分子または共有結合化合物を一緒に保つかを理解するには、これら 2 つの力の機能を別々に知ることが重要です。
この記事では、
1.水素結合とは?
2.分子間水素結合とは
– 定義、特徴と特性、例
3.分子内水素結合とは
– 定義、特徴と特性、例
4.分子間水素結合と分子内水素結合の違いは何ですか? 
水素結合とは
電気陰性度が中程度の水素が、電気陰性度の高い原子に共有結合すると、水素が共有する電子対は電気陰性度の高い原子に偏ります。このような原子の例としては、N、O、および F があります。水素結合が形成されるには、水素受容体と水素供与体が必要です。水素供与体は分子内の電気陰性度の高い原子であり、水素受容体は隣接分子内の電気陰性度の高い水素原子であり、孤立電子対を持っている必要があります。
水素結合は、2 つの分子間または分子内で発生します。これらの 2 つのタイプは、それぞれ分子間水素結合と分子内水素結合として知られています。
分子間水素結合とは
分子間水素結合は、同種または異種の分子間で発生する可能性があります。アクセプター原子の位置は、ドナーと相互作用できるように適切に配置する必要があります。
シナリオを明確に理解するために、水分子を見てみましょう。
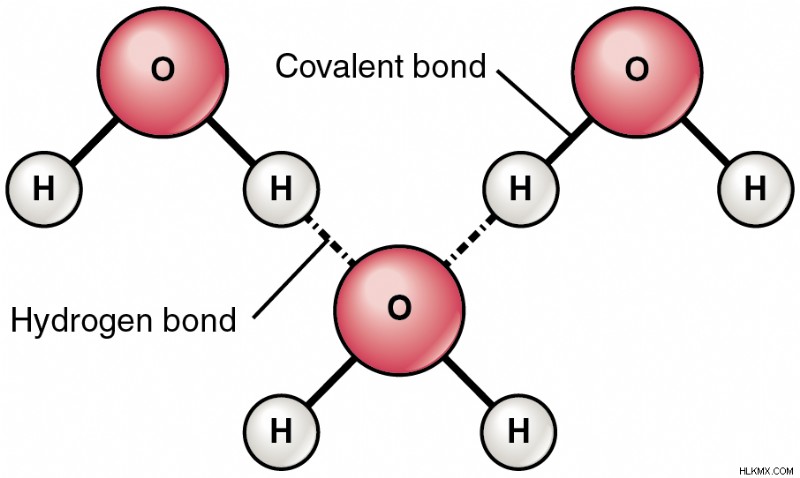
図 1:水分子の水素結合
H 原子と O 原子の間で共有される電子対は、酸素原子の方に引き寄せられます。したがって、O原子はH原子と比較してわずかに負の電荷を取得します。 O原子はδ-、H原子はδ+で表されます。 2 番目の水分子が前者に近づくと、一方の水分子の δ- O 原子と他方の δ+ H 原子の間に静電結合が形成されます。分子内の酸素原子はドナー (B) とアクセプター (A) として振る舞い、一方の O 原子が他方に水素を供与します。
水は、水素結合により非常に特殊な性質を持っています。沸点が高く、表面張力が高く、良溶媒です。さらに、4℃の氷は水よりも密度が低くなります。したがって、氷は液体の水に浮かび、冬の間、その下の水生生物を保護します。水のこれらの特徴から、それは万能溶媒と呼ばれ、地球上の生命を維持する上で重要な役割を果たしています.
分子内水素結合とは
水素結合が同じ分子の 2 つの官能基内にある場合、それは分子内水素結合と呼ばれます。これは、水素供与体と受容体が両方とも同じ分子内にある場合に発生します。

図 2:分子内水素結合を持つ o-ニトロフェノール (オルト-ニトロフェノール) の構造
O-ニトロ フェノール分子では、-OH 基の O 原子は H よりも電気陰性度が高いため、δ- になります。一方、H原子はδ+です。したがって、–OH グループの O 原子は H ドナーとして機能し、ニトロ基の O 原子は H アクセプターとして機能します。
分子間水素結合と分子内水素結合の違い
絆の形成
分子間水素結合: 分子間水素結合は、隣接する 2 つの分子間で発生します。
分子内水素結合: 分子内水素結合は、分子自体の中で発生します。
物理的特性
分子間水素結合: 分子間水素結合は融点と沸点が高く、蒸気圧が低い。
分子内水素結合: 分子内水素結合は、融点と沸点が低く、蒸気圧が高いです。
安定性
分子間水素結合: 安定性は比較的高いです。
分子内水素結合: 安定性は比較的低いです。
例
分子間水素結合: 水、メチルアルコール、エチルアルコール、砂糖は、分子間水素結合の例です。
分子内水素結合: O-ニトロフェノールとサリチル酸は、分子内水素結合の例です。
まとめ – 分子間水素結合と分子内水素結合
分子間水素結合を持つ化合物は、分子内水素結合を持つ化合物よりも安定です。分子間水素結合は、1 つの分子を他の分子に接続し、結合を維持する役割を果たします。それとは反対に、分子内水素結合が発生すると、分子は互いに相互作用する可能性が低くなり、分子がくっつきにくくなります。これは、沸点と融点の低下につながります。さらに、分子内水素結合を持つ分子はより揮発性が高く、蒸気圧が比較的高くなります。
分子間水素結合を持つ化合物は、類似の性質を持つ化合物に容易に溶解しますが、分子内水素結合を持つ化合物は容易に溶解しません.
"水素結合。" 化学LibreTexts . Libretexts、2016 年 7 月 21 日。ウェブ。 2017 年 2 月 7 日。
「水素結合:アクセプターとドナー」。ウィスコンシン大学、n.d.ウェブ。 2017 年 2 月 7 日。
「アルコール、カルボン酸、その他の分子の分子間および分子内水素結合とその意義」 有機化学 . N.p.、10月2012. ウェブ。 2月7日2017.
「分子内水素結合と分子間水素結合の強さ」 化学スタック交換 . N.p.、2013年。ウェブ。 2017 年 2 月 7 日。
画像提供:
「O-Nitrophenol Wasserstoffbrücke」 NEUROtiker 著 – Commons Wikimedia 経由の自身の作品 (パブリック ドメイン)
「210 Hydrogen Bonds Between Water Molecules-01」 OpenStax College – Anatomy &Physiology、Connexions Web サイトによる。 (CC BY 3.0) コモンズ ウィキメディア経由







