1884 年、スヴァンテ アレニウスというスウェーデンの科学者がイオン化の理論に取り組み、それに基づいて酸と塩基の特性を説明しようとしました。スバンテが提唱した理論では、酸が水と混ざるとどのように反応し、塩基が水と一緒に保たれるとどのように反応するかを説明しました。その結果、水と酸を混合すると、酸が溶液中に H+ イオンを放出し、酸に水素が含まれていることがわかりました。一方、水と塩基を混合すると、溶液中に存在する塩基が水と解離した OH- イオンを放出します。
電解質が水に溶解すると、陽イオンと陰イオンとして電気的に正と負に帯電したイオンに分離され、それぞれイオン化と見なされます。アレニウスは、等しいという概念に基づいて、酸と塩基の区別をつけようと努力しました。
酸と塩基の違い
アレニウス酸
アレニウスによれば、酸は水溶液中の水素イオンの関心を拡張するあらゆる種であり、彼はそう考えた!何らかの目的で塩酸水溶液を作ると、溶液はそれぞれの反応の生成物として水素イオンと塩素イオンに解離しますが、これはかなり重要です。これらの結果、溶液中の水素イオンの形成が増加するため、特に塩酸は、洗練された方法でアレニウス酸です。
実際には、実験室で反応が起こると、一般に信じられていることとは反対に、プラスに帯電したプロトンが周囲の水分子と反応してヒドロニウムイオンを形成します。そして、これは反応時に実際に起きていることなのですが、科学者たちは水素イオンに相当するヒドロニウムイオンを摂取します。このようにして、誰にとっても最も一般的な結果が得られます。この応答は、上記の情報が正しいことを証明する方法を示す非常に一般的な例を通じて示すことができ、実際には次のように記述されます:
H+ (aq) + H2O (l) → H3O+ (aq)
瞬時の結果として、酸が水と解離すると、ヒドロニウム イオンの形成が見られます。これは主に、科学者が化学反応について話す際に、水素イオンとヒドロニウム イオンが同様の基礎にあることを考慮に入れるときに使用されます。
アレニウス基地
アレニウス塩基は、水と解離してヒドロキシルイオンを放出する種です。水溶液中のヒドロキシル イオンの濃度が増加します。
アレニウス塩基の例:溶解度の高い水酸化ナトリウムがその例です。水酸化ナトリウムは水中で次のように解離します:
NaOH (aq) → Na+ (aq) + OH– (aq)
アレニウス酸 + アレニウス塩基
その過程で酸と塩基が化学反応を起こし、互いに結合を形成する反応が中和反応であることが知られています。その結果、最終的に購入する製品は水と塩です。
酸が水に解離する過程で水素イオンが生成され、塩基が水に解離すると水酸化物イオンが生成される場合、これは水と塩がどのように分解されるかについての主要な専門知識を提供します。酸と塩基の両方の応答の期間中に作成されます。
酸側から発生した水素イオンと塩基側から発生した水酸化物イオンが混ざり合い、その結果、水ができます。酸と塩基の残りの種が手をつないで塩を形成します。
たとえば、次のように仮定します。フッ化水素酸と水酸化リチウムの水溶液を組み合わせると、次の反応が起こります:
HF (aq) ⇄ H+ (aq) + F– (aq)
その結果、形成された生成物は順番に昇順反応を起こします最終製品として水と塩を形成します。 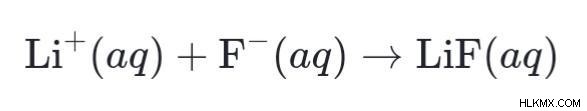
LiOH (aq) → Li+ (aq) + OH– (aq)
酸と塩基のアレニウス理論の限界:-
この理論は、水溶液中の酸と塩基にのみ適用できます。
H+ (aq) + OH– (aq) →H2O (l)
結論
スヴァンテ・アレニウスという科学者は、人気のある「酸と塩基のアレニウス理論」、水溶液の存在下でのそれぞれの特性、およびイオン化理論がそれとどのように関連しているかを示し、ノーベル賞を受賞しました。同じように。しかし、その理論は水溶液に限定されており、アレニウスの酸と塩基の理論の限界である非水溶液の特性を満たすことができませんでした。